https://doi.org/10.18593/evid.34486
Perfil de susceptibilidade a antimicrobianos de cepas de Aspergillus sp. isolados de solo impactado
Antimicrobial susceptibility profile of Aspergillus sp. Strains. impacted soil isolates
Sarah Vieira Guimarães1, Geovanna da Silva Pinho Belém2, Sthefany Lima Pires3, Danyelle Cristina Pereira Santos4, Suelem dos Santos Amaral Gouveia5, Rita de Cássia Mendonça de Miranda6
Resumo: A composição do solo do lixão abriga uma diversidade de microrganismos que podem tornar-se patogênicos para os seres humanos, como os do gênero Aspergillus sp. Esse gênero de fungos é caracterizado pela capacidade de alteração genética para o aumento da sua resistência. Portanto o objetivos desse trabalho foi avaliar o perfil de resistência de fungos do gênero Aspergillus sp. isolados do solo impactado de lixão da cidade de Apicum-Açu, estado do Maranhão, Brasil. Para tal foram utilizadas cepas de Aspergillus sp. (ASP 2, ASP3 e ASP 4), isoladas de solo impactado, sendo empregada a técnica de microcultivo, para confirmação do gênero. A susceptibilidade desses microrganismos a agentes antifúngicos foi avaliada utilizando a técnica de Concentração Inibitória Mínima (CIM) por microdiluição seriada (1:2), na qual trabalhou-se os antifúngicos Anfotericina B (16 a 0,0312 mg/L), Voriconazol (16 a 0,0312 mg/L) e Itraconazol (8 a 0,0156 mg/L). O isolado ASP2 apresentou resistência ao Voriconazol (>2 mg/L) e resultado indefinido para os antifúngicos Itraconazol e Anfotericina B. O ASP3 demonstrou sensibilidade para Itraconazol (0,5 mg/L) e Voriconazol (0,25 mg/L), entretanto, resultado indefinido para Anfotericina B. Por fim, o isolado ASP4 apresentou resistência a Anfotericina B (2 mg/L) e sensibilidade para Itraconazol (0,5 mg/L) e Voriconazol (1 mg/L). Dessa forma, evidencia-se o aumento da resistência de Aspergillus sp., e a ineficiência do grau de susceptibilidade desses fármacos frente as patologias, necessitando assim, de estudos mais aprofundados e de pesquisas sobre novas biomoléculas, que permitirão resultados mais eficientes contra esse gênero de fungos.
Palavras-chave: Aspergilose; Agentes antifúngicos; Sensibilidade microbiana.
Abstract: The composition of the landfill soil harbors a diversity of microorganisms that can become pathogenic to humans, such as those of the genus Aspergillus sp. This genus of fungi is characterized by the capacity for genetic alteration to increase resistance. Therefore, the aims of this work were to evaluate the resistance profile of fungi of the genus Aspergillus sp. isolated from impacted landfill soil in the city of Apicum-Açu, state of Maranhão, Brazil. For this purpose, strains of Aspergillus sp. (ASP 2, ASP3 and ASP 4), isolated from impacted soil, using the microculture technique to confirm the gender. The susceptibility of these microorganisms to antifungal agents was evaluated using the Minimum Inhibitory Concentration (MIC) technique by serial microdilution (1:2), in which the antifungals Amphotericin B (16 to 0.0312 mg/L), Voriconazole ( 16 to 0.0312 mg/L) and Itraconazole (8 to 0.0156 mg/L). Isolate ASP2 showed resistance to Voriconazole (>2 mg/L) and indefinite results for the antifungals Itraconazole and Amphotericin B. ASP3 demonstrated sensitivity to Itraconazole (0.5 mg/L) and Voriconazole (0.25 mg/L), however, the result was undefined for Amphotericin B. Finally, the ASP4 isolate showed resistance to Amphotericin B (2 mg/L) and sensitivity to Itraconazole (0.5 mg/L) and Voriconazole (1 mg/L). In this way, the increased resistance of Aspergillus sp. is evident, and the inefficiency of the degree of susceptibility of these drugs against pathologies, thus requiring more in-depth studies and research into new biomolecules, which will allow more efficient results against this genus. of fungi.
Keywords: Aspergillosis; Antifungal Agents; Microbial Sensitivity.
Recebido em 23 de dezembro de 2023
Aceito em 27 de março de 2024
INTRODUÇÃO
O solo é um habitat diversificado, tendo em sua composição fatores físicos, químicos e biológicos, para garantia da sua qualidade. Sua microbiota variada, com microrganismos que atuam em ciclos bioquímicos para a manutenção da vida, inclui espécies de fungos que são responsáveis por diversas atividades, como a decomposição de compostos complexos em pequenas moléculas, mineralização, produção de compostos e enzimas extracelulares para adaptação e competição por espaço (Fidelis et al., 2016; Freitas et al., 2017; Leal et al., 2021).
Em ambientes adversos, como os lixões, nos quais o solo está exposto a diversas contaminações, encontram-se uma ampla variedade de microrganismos, incluindo espécies de bactérias e fungos. Entre os microrganismos, destacam-se os Aspergillus sp., que possuem a capacidade de desenvolver estratégias para a sobrevivência nesse ambiente estressante (Munoz-Rojas et al., 2016).
Esse gênero de fungos filamentosos pertencentes à família Aspergillaceae, destacam-se pela característica distintiva na sua morfologia, composta por conidióforos que terminam em uma vesícula apical, e que por sua vez apresentam uma célula basal do pé que se insere na hifa na extremidade oposta. Dependendo da espécie, as características da vesícula biliar podem sofrer variações. Da mesma forma, os fungos desse gênero são classificados como saprófitos, que se alimentam de matéria orgânica morta ou em decomposição. Por isso, são considerados uma parte importante das cadeias alimentares dos ecossistemas em que se encontram, sendo poderosos decompositores de matéria orgânica, transformando-a em composto para o solo (Brandl; Andersen, 2017; Vadlapudi et al., 2017).
Visto que as doenças causadas pela cepa Aspergillus sp., são apontados como um problema de saúde significativo, estudos relacionados tonam-se cada vez mais promissores, uma vez que essa cepa pode levar ao desenvolvimento de doenças pulmonares, como aspergilose pulmonar e sinusite fúngica, além de afetar as unhas e causar onicomicose. A forma clínica dessas aspergilloses depende diretamente do estado imunológico do indivíduo (Gavronski et al, 2016)
A dispersão de seus esporos no meio ambiente facilita a infecção pelo trato respiratório e infecção de uma ferida anterior ou de membranas mucosas. Os fungos patogênicos produzem quatro tipos de toxinas B1, B2, G1 e G2. O efeito tóxico destas aflatoxinas pode ser de curta duração (aflatoxicose aguda) ou de longa duração (aflatoxicose crônica) (Souza et al., 2017)
Devido a prevalência dessas espécies de Aspergillus sp. e sua eficiente capacidade de alteração genética para aumento de resistência biológica contra ambientes estressantes, é necessário a realização de testes com agentes antifúngicos mais comumente utilizados no cotidiano clínico, visando resultados comprobatórios do grau de susceptibilidade desses fármacos frente a essas patologias (Braga, 2018).
Sabendo que o solo do lixão é rico em espécies de fungos que residem nesse ambiente hostil, o presente trabalho tem como objetivo avaliar o perfil de resistência de Aspergillus spp. isolados do solo impactado de lixão da cidade de Apicum-Açu, estado do Maranhão, Brasil.
MATERIAL E MÉTODO
TIPO DE ESTUDO
Esse estudo trata-se de uma pesquisa transversal experimental, com abordagem quantitativa e qualitativa, que visa perfil de susceptibilidade a antimicrobianos de cepas de Aspergillus spp. isolados do solo impactado.
ISOLADOS PARA O TESTE DE SUSCEPTIBILIDADE ANTIFÚNGICA
Para o teste de susceptibilidade antifúngica, foram utilizadas cepas dos isolados do gênero Aspergillus spp. identificados como ASP2, ASP3, ASP4, isolados do solo e disponíveis no banco de cultura do Laboratório de Eletroquímica e Biotecnologia da Universidade Ceuma.
Essas cepas de Aspergillus spp. foram previamente isoladas de um solo impactado do aterro sanitário do município de Apicum-Açu, situado no estado do Maranhão, Brasil. A área de estudo fica localizada nas seguintes coordenadas geográficas: Latitude: 1° 34’ 37’’ Sul; Longitude: 45° 4’ 46’’ Oeste (Figura 1)
MICROCULTIVO E IDENTIFICAÇÃO
Para confirmação e identificação das cepas de Aspergillus spp. utilizados no estudo a nível de gênero, empregou-se a técnica de microcultivo para examinar as características morfológicas dos isolados, seguindo o protocolo de Holt, Williams e Sharpe (1989), com modificações específicas. Foram preparadas placas contendo o meio de cultura BDA (Ágar Batata Dextrose), nas quais as cepas foram inoculadas. Em seguida, uma lamínula inclinada foi cuidadosamente colocada sobre o meio. Estas placas foram incubadas em uma estufa a 28°C por um período de 7 dias. Após o período de incubação, a lamínula foi cuidadosamente removida e colocada sobre uma lâmina de vidro, onde foi corada com azul de algodão. Isso permitiu a análise das amostras sob um microscópio óptico, utilizando uma objetiva de 40x para examinar as características morfológicas dos microrganismos e, consequentemente, sua identificação.
Figura 1: Mapa dos pontos de coleta de solo do lixão localizado no município de Apicum-Açu, Maranhão, Brasil.
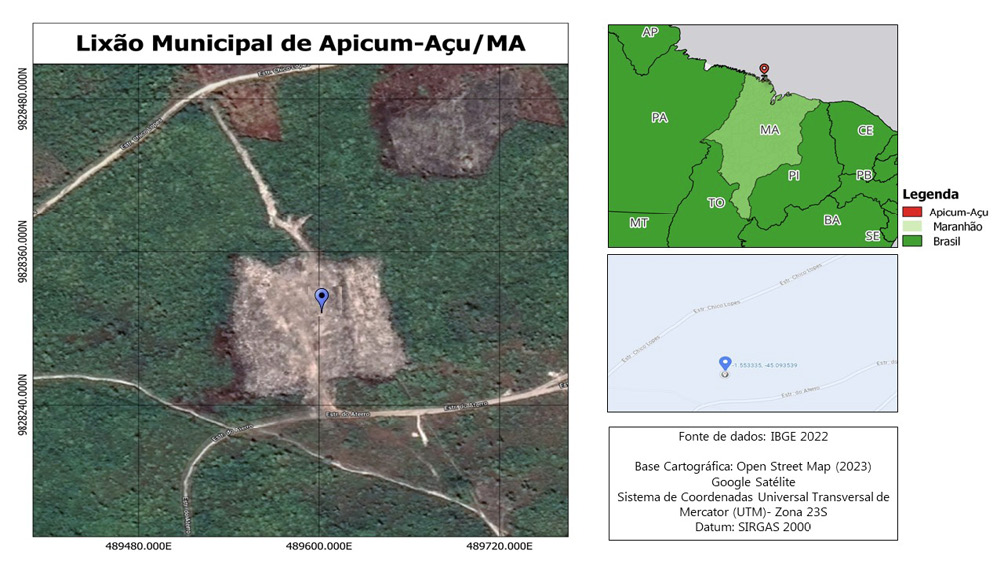
Fonte: Autores,2023
DETERMINAÇÃO DA CONCENTRAÇÃO INIBITÓRIA MÍNIMA (CIM)
A determinação da Concentração Inibitória Mínima (CIM) para a avaliação do perfil de susceptibilidade das cepas de Aspergillus sp. foi realizada por meio do ensaio de microdiluição (1:2) em microplaca de 96 poços (BrCAST, 2017). Os micélios aéreos e vegetativos dos fungos filamentosos foram coletados com auxílio de um swab umedecido e depositados em salina (0,9%), até atingir a concentração semelhante a escala McFarland 0,5 (1,5 x 108 UFC/ml). Os inóculos foram padronizados pela diluição de 1:10 em meio RPMI 1640 suplementado (2-5 x 105 UFC/ml). Em microplaca de 96 poços, foi realizada a diluição seriada dos antifúngicos Anfotericina B (16 a 0,0312 mg/L), Itraconazol (8 a 0,0156 mg/L) e Voriconazol (16 a 0,0312 mg/L), em meio RPMI 1640 suplementado, com volume final de 100 µl em cada poço do ensaio (Figura 2). Foi adicionado a alíquota 100 µl de cada inóculo padronizado nos poços com os antifúngicos diluídos. O controle negativo consistiu em somente meio RPMI 1640 suplementado, e o positivo, em meio RPMI 1640 suplementado e inóculo padronizado. O teste foi realizado em triplicata. Incubou-se as placas a 28ºC entre 24 e 48 horas. O resultado da susceptibilidade a antifúngico foi lido visualmente, sendo considerada como CIM a menor concentração sem crescimento microbiano. As referências dos pontos de cortes seguiram o preconizado pela literatura (BrCAST, 2017; Arendrup et al., 2012; Hope et al., 2013).
Figura 2: Ilustração da organização da microplaca de 96 poços para determinação da Concentração Inibitória Mínima (CIM).
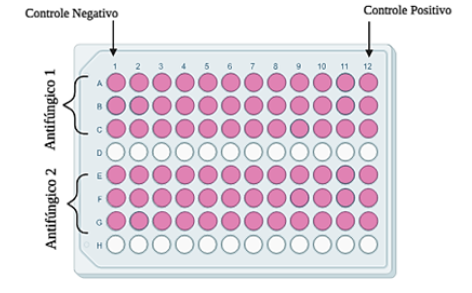
Fonte: Autores,2023
RESULTADOS
Nesse estudo, foram utilizadas cepas do gênero Aspergillus sp., advindas do aterro sanitário da região de Apicum-Açu, no Maranhão, disponibilizadas pelo banco de cultura do Laboratório de Eletroquímica e Biotecnologia da Universidade Ceuma. As características macroscópicas e microscópicas das colônias foram examinadas visando a identificação do gênero.
Os isolados foram identificados como: ASP2, ASP3, ASP4. O isolado ASP 2 (Figura 3), identificado como Aspergillus sp., apresentou colônias acinzentadas, com liberação de pigmento verde e micélio aéreo predominante (Figura 3A), além da observação de hifas cenocíticas, foi identificada a formação de esporos dispostos em padrão semelhante a uma flor (Figura 3B).
O isolado ASP4 (Figura 5), identificado como Aspergillus sp., apresentou colônias acinzentadas, com micélio aéreo predominante e liberação de pigmento rósea (Figura 5A), sendo caracterizado por hifas septadas e cabeça aspergilar com formação de esporos dispostos em padrão semelhante a uma flor (Figura 5B).
No teste de determinação da CIM (Concentração Inibitória Mínima) utilizado para a avaliação do perfil de susceptibilidade das cepas de Aspergillus sp. observou-se os principais resultados, resumidos na Tabela 1.
O isolado ASP3 (Figura 4), identificado como Aspergillus sp., apresentou colônias esbranquiçadas e micélio aéreo predominante (Figura 4A), além da observação de hifas cenocíticas, foi identificada a formação de esporos dispostos em padrão semelhante a uma flor (Figura 4B).
Figura 3: Análise macro e microscópica do isolado ASP2 (Aspergillus sp.) do solo do aterro sanitário de Apicum-Açu, Maranhão, Brasil.

Fonte: Autores,2023
Figura 4: Análise macro e microscópica do isolado ASP3 (Aspergillus sp.) do solo do aterro sanitário de Apicum-Açu, Maranhão, Brasil.

Fonte: Autores, 2023
Figura 4: Análise macro e microscópica do isolado ASP4 (Aspergillus sp.) do solo do aterro sanitário de Apicum-Açu, Maranhão, Brasil.
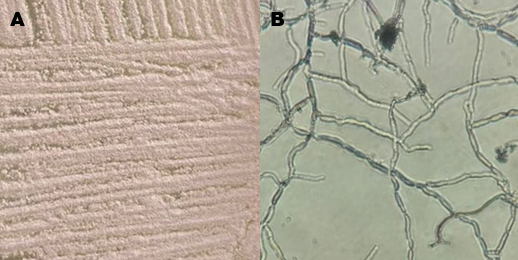
Fonte: Autores, 2023
Tabela 1. Perfil de susceptibilidade a antifúngico de cepas de Aspergillus sp. isolados de solo impactado do lixão de Apicum-Açu, Maranhão, Brasil (2023).
|
Antifúngicos (mg/L) |
Isolados |
|||
|
ASP 2 |
ASP 3 |
ASP 4 |
Ponto de Corte (mg/L) |
|
|
Anfotericina B |
ND |
ND |
2 |
S≥1; R>2 |
|
Itraconazol |
ND |
0,5 |
0,5 |
S≥1; R>2 |
|
Voriconazol |
2 |
0,25 |
1 |
S≥1; R>2 |
Legenda: ND – Não definido; S – Sensível; R – Resistente
Fonte: Autores, 2023
Os antifúngicos avaliados no teste de CIM por microdiluição seriada incluem anfotericina B (16 mg a 0,0312 mg/L), itraconazol (8 mg a 0,0156 mg/L) e voriconazol (16 mg a 0,0312 mg/L). De acordo com a Tabela 1, o isolado ASP2 se manifestou resistente a voriconazol (>2,0 mg/L) e resultado indefinido para anfotericina B e itraconazol. Já isolado ASP3, mostrou-se sensível a itraconazol (0,5 mg/L) e voriconazol (0,25 mg/L), entretanto, apresentou resultado indefinido para anfotericina B. Por fim, o isolado ASP4 manifestou-se resistente a anfotericina B (2,0 mg/L), porém sensível a itraconazol (0,5 mg/L) e voriconazol (1,0 mg/L).
DISCUSSÃO
O gênero Aspergillus engloba mais de 200 espécies, com uma estimativa de cerca 34 espécies descritas como causadoras de infecções em humanos, podendo-se citar as espécies Aspergillus niger, Aspergillus flavus, Aspergillus terreus, Aspergillus nidulans e Aspergillus fumigatus, sendo essa última a espécies mais associadas aos casos de aspergilose (Quintanilha-Peixoto et al., 2019).
A porta de entrada do fungo do gênero Aspergillus sp. no organismo é por meio de inalação de seus conídios. Porém, indivíduos saudáveis são capazes de eliminarem a infecção antes do desenvolvimento de qualquer doença. A aspergilose atinge, principalmente, pacientes imunodeprimidos com exposição direta ao fungo, como trabalhadores e catadores do lixão de Apicum-Açu (MA) em contato com o solo. Um mínimo desequilíbrio entre o fungo e o hospedeiro pode levar ao desenvolvimento da doença (Shibuya et al., 2004).
Nos últimos anos, o avanço das terapias imunossupressoras aumentou o risco de infecções oportunistas, evidenciando o Aspergillus spp. como um dos principais patógenos fúngicos humano. Embora tenha sido usado na indústria alimentícia e farmacêutica, recentemente, sua relevância cresceu devido a infecções oportunistas, resultando em um impacto significativo na saúde pública. O termo geral para essa condição é aspergilose, englobando doenças causadas por agentes do gênero Aspergillus. (Sales, 2009).
Os principais antifúngicos de primeira escolha utilizados no tratamento da infecção por Aspergillus sp. são os azólico, como voriconazol, posaconazol e isavuconazol, e azóis, como o itraconazol. Outras classes de antifúngicos também são utilizadas individualmente ou em conjunto, como a flucitosina e/ou a anfotericina B. No entanto, a crescente taxa de resistência do gênero a antifúngicos, em especial os azólicos, dificulta o tratamento da doença, sendo o ambiente apontado como fator crucial da seleção às cepas resistentes, principalmente ambientes hostis e impactados que induzem a manifestação de fatores de sobrevivência microbiana (Sales, 2009; REICHERT‐LIMA et al., 2018).
Com base nos resultados obtidos, observa-se diferentes graus de sensibilidade e resistências de isolados de Aspergillus sp. do solo impactado avaliado nesse estudo. Pode-se demonstrar que os isolados ASP3 e ASP4 demonstram sensibilidade esperada ao antifúngico azólico (voriconazol) e azóis (itraconazol). O isolado ASP2 apresentou resistência ao voriconazal. Nenhum isolado apresentou sensibilidade à anfotericina B.
De acordo com o estudo conduzido por Pontes (2018), foram constatados casos de resistência antifúngica evidenciados através do teste de determinação da CIM. Dessa forma, o estudo indicou que Aspergillus pode ser resistente a outros medicamentos antifúngicos, incluindo o posaconazol, derivado azólico utilizado principalmente para o tratamento de aspergilose. Segundo a pesquisa de Reichert-Lima (2018), foram encontrados resultados semelhantes em relação aos antifúngicos anfotericina B e posaconazol, com resistência de Aspergillus aos medicamentos testados. Denardi et al. (2018) analisou a suscetibilidade antifúngica de isolados clínicos e ambientais de duas espécies de Aspergillus sp., observando cerca de 20 a 25% das cepas clínicas e ambientais isoladas foram apontadas como resistentes ao itraconazol, além de apontar boa atividade de voriconazol e anfotericina B. Todos esses ensaios corroboram com os resultados desse estudo, demonstrando o potencial de resistência do gênero Aspergillus.
Dessa forma, fica em evidência a importância e a necessidade de se avaliar o perfil de susceptibilidade de isolados de Aspergillus sp., principalmente quando são provenientes de solo impactado, uma vez que o ambiente hostil pode selecionar cepas resistentes.
CONCLUSÃO
Os isolados ASP3 e ASP4 apresentaram sensibilidade aos antifúngicos itraconazol e voriconazol, e o isolado ASP2 apresentou resistência ao voriconazol. Ambas as cepas isoladas foram resistentes ou apresentaram resultados indefinidos para anfotericina B. Diante disso, observa-se o aumento da resistência de Aspergillus sp., isolado do solo impactado do aterro sanitário do município de Apicum-Açu, Maranhão e a ineficiência do grau de susceptibilidade desses fármacos frente as patologias causadas por esse fungo, necessitando assim, de estudos mais aprofundados e de pesquisas sobre novas biomoléculas, que permitirão resultados mais eficientes contra esse gênero de fungos.
REFERÊNCIAS
ARENDRUP, M. C. et al. EUCAST technical note on Aspergillus and amphotericin B, itraconazole, and posaconazole. Clinical Microbiology and Infection, v. 18, n. 7, p. E248-E250, 2012.
BRANDL, J.; ANDERSEN, M. R. Aspergilli: Models for systems biology in filamentous fungi. Current Opinion in Systems Biology, v. 6, p. 67–73, 2017.
BRAGA, V. F. Determinação da prevalência das espécies, resistência a antifúngicos e perfil de virulência de Aspergillus spp. oriundos de amostras de origem clínica. 2018. Dissertação (Mestrado em Biociências Aplicadas à Farmácia) - Faculdade de Ciências Farmacêuticas de Ribeirão Preto, Universidade de São Paulo, Ribeirão Preto, 2018.
BrCAST. Brazilian Committee on Antimicrobial Susceptibility Testing. Método para determinação de concentração inibitória mínima em caldo dos agentes antifúngicos para fungos filamentosos formadores de conídios. EUCAST – Documento definitivo E.DEF. 9.3.1, 2017.
DENARDI, L. B. et al. In vitro antifungal susceptibility of clinical and environmental isolates of Aspergillus fumigatus and Aspergillus flavus in Brazil. Brazilian jornal of Infectiuos Diseases, v. 22, n. 1, p. 30-36, 2018.
FIDELIS, R. R. et al. Indicadores biológicos de qualidade do solo em culturas intercalares ao pinhão manso. Brazilian Journal of Applied Technology for Agricultural Science, v. 9, n. 3, 87-95, 2016.
FREITAS, L. et al. Indicadores da qualidade química e física do solo sob diferentes sistemas de manejo. Unimar Ciências, v. 26, n. 1-2, p. 8-25, 2017.
GAVRONSKI, S. et al. Diagnóstico laboratorial de aspergilose invasiva: avaliação de métodos moleculares e detecção de antígenos. Revista Brasileira de Análises Clínicas, v. 48, n. 2, p. 96-109, 2016.
HOLT, J. G. et al. Bergey’s manual of systematic bacteriology. Baltimore: Williams & Wilkins, v. 4 p. 2300-2648, 1989.
HOPE, W. W. et al. EUCAST technical note on voriconazole and Aspergillus spp. Clinical Microbiology and Infection, v. 19, n. 6, p. E278-E280, 2013.
LEAL, M. L. A. et al. Efeito dos sistemas de manejo e do uso do solo na população de microrganismos do solo. Research, Society and Development, v. 10, n. 9, p. e21910917966-e21910917966, 2021.
MUNOZ-ROJAS M. et al. Soil physicochemical and microbiological indicators of short-, medium- and long-term post-fire recovery in semi-arid ecosystems. Ecological Indicators, v. 63, p. 14–22, 2016.
PONTES, L. Vigilância de resistência frente a antifúngicos azólicos de isolados clínicos de Aspergillus fumigatus. 2018. 1 recurso online (77 p.) Dissertação (mestrado) - Universidade Estadual de Campinas, Faculdade de Ciências Médicas, Campinas, 2018.
QUINTANILHA-PEIXOTO, G. et al. Calm before the storm: A glimpse into the secondary metabolism of Aspergillus welwitschiae, the etiologic agent of the sisal bole rot. Toxins, v. 11, n. 11, p. 631, 2019.
REICHERT‐LIMA, F. et al. Surveillance for azoles resistance in Aspergillus spp. highlights a high number of amphotericin B‐resistant isolates. Mycoses, v. 61, n. 6, p. 360-365, 2018.
SALES, Maria da Penha Uchoa. Capítulo 5-Aspergilose: do diagnóstico ao tratamento. Jornal Brasileiro de Pneumologia, v. 35, p. 1238-1244, 2009.
SHIBUYA, Kazutoshi et al. Pathophysiology of pulmonary aspergillosis. Journal of Infection and Chemotherapy, v. 10, n. 3, p. 138-145, 2004.
SOUZA, D. R. et al. Efeitos tóxicos dos fungos nos alimentos. Revinter, v. 10, n. 2, p. 73-84, 2017.
VADLAPUDI, V. et al. Aspergillus Secondary Metabolite Database, a resource to understand the Secondary metabolome of Aspergillus genus. Scientific Reports, v. 7, no. 1, p. 1–10, 2017.
1 Enfermagem, Universidade CEUMA, São Luís-MA, Brasil. E-mail: sarahvieira230@gmail.com ORCID: https://orcid.org/0009-0001-0817-1328
2 Enfermagem, Universidade CEUMA, São Luís-MA, Brasil. E-mail: geovannabelem@gmail.com. ORCID: https://orcid.org/0009-0006-7963-8454
3 Biomedicina, Universidade CEUMA, São Luís-MA, Brasil. E-mail: tk.pires03@gmail.com. ORCID: https://orcid.org/0009-0008-4593-4065
4 Mestre em Biologia Microbiana, Universidade Ceuma, São Luís-MA, Brasil. E-mail: Danyellesantosbiomed@gmail.com. ORCID: https://orcid.org/0000-0002-8402-9913
5 Farmacêutica, Universidade CEUMA, São Luís-MA, Brasil. E-mail: suelemfarma@hotmail.com. ORCID: https://orcid.org/0000-0003-0431-101X
6 Doutora em Biologia de Fungos, Universidade Ceuma, São Luís-MA. E-mail: rita.miranda@ceuma.br. ORCID: https://orcid.org/0000-0003-2116-1797; Autor correspondente.