Biociências
Selênio na germinação de sementes, no desenvolvimento e acúmulo de nutrientes em plântulas de pitaia in vitro (Hylocereus Costaricensis)
Selenium in seed germination, development and nutrient accumulation in in vitro dragon fruit seedlings (Hylocereus Costaricensis)
Sarah Dias Azevedo¹, Gabrielen de Maria Gomes Dias¹, Márcio Cleber de Medeiros Corrêa¹, & Antônio Mateus Pinheiro¹
¹ Departamento de Fitotecnia, Universidade Federal do Ceará (UFC) – Fortaleza, CE, Brasil
Como citar: Azevedo, S. D., Dias, G. de M. G., Corrêa, M. C. de M., & Pinheiro, A. M. Selênio na germinação de sementes, no desenvolvimento e acúmulo de nutrientes em plântulas de pitaia in vitro (Hylocereus Costaricensis). Evidência, 24. https://doi.org/10.18593/evid.34242
Azevedo, S. D.*
https://orcid.org/0000-0002-5105-1794
Dias, G. de M. G.
https://orcid.org/0000-0001-6503-7865
Corrêa, M. C. de M.
https://orcid.org/0000-0001-9572-4463
Pinheiro, A. M.
https://orcid.org/0000-0001-7354-7750
* Autora correspondente: Rua Dr. Airton bezerra, n.º 129, Jose de Alencar, Fortaleza-CE, Brasil.
RESUMO: A técnica de cultura de tecidos de plantas pode ser uma ferramenta eficaz de propagação da pitaieira, visto que, por meio dela as mudas são multiplicadas em grande quantidade, produzindo clones idênticas à planta mãe, livres de patógenos e em curto período de tempo. O trabalho foi realizado com objetivo avaliar os efeitos do selênio na forma de selenato de sódio (Na2SeO4) via meio de cultura na germinação, enraizamento, crescimento dos cladódios e no acúmulo de nutrientes em pitaias (Hylocereus costaricensis) cultivadas in vitro. Foram utilizadas sementes pitais (Hylocereus costaricensis) inoculadas em meio MS adicionado de selenato de sódio (Na2SeO4) nas concentrações 0,0; 28,0; 34,0; 40,0; 46,0 e 52,0 μmol L-1, com 25 repetições. Além disso, foram adicionados 10 mg L-1 de BAP e 0,1 mg L-1 de ANA nos tratamentos com selênio. O experimento foi disposto em delineamento inteiramente casualizado e os tubos foram mantidos em sala de crescimento durante 60 dias. Os parâmetros avaliados foram: taxa de germinações, comprimento da plântula, número de cladódios, número de raízes e comprimento dos cladódios comprimento (cm). A quantificação dos elementos foi realizada com plasma acoplado indutivamente (ICPMS). Os dados foram avaliados através de curvas de regressão polinomial. Todas as analises estatísticas foram realizadas no software R Studio. A inclusão de selenato de sódio ao meio de cultura proporcionou melhora na taxa de germinação, número de cladódios, comprimento de cladódios e comprimento das plântulas de H. costaricensis. Contudo, com exceção do número de cladódios, todos os demais parâmetros filotécnicos avaliados aparentaram melhor desenvolvimento com centrações estimadas menores que a 28 µmol L-1 (menor concentração utilizada), indicando que em doses menores as plantas teriam um melhor desenvolvimento. Além disso, a disponibilidade de selênio no meio de cultura foi proporcional a sua absorção em plântulas de H. costaricensis e a adição de Se no meio MS afetou a absorção de nutrientes pela H. costaricensis.
Palavras-chave: Selenato, Cultura de tecidos, Pitaya.
ABSTRACT: The plant tissue culture technique can be an effective tool for propagating the pitai tree, since through it the seedlings are multiplied in large quantities, producing clones identical to the mother plant, free of pathogens and in a short period of time. The work was carried out with the objective of evaluating the germination of pitaya seeds (Hylocereus costaricensis) grown in vitro with added selenium and the development of resulting seedlings. Pital seeds (Hylocereus costaricensis) were used inoculated in MS medium added with sodium selenate (Na2SeO4) at concentrations 0.0; 28.0; 34.0; 40.0; 46.0 and 52.0 μmol L-1, with 25 repetitions. Furthermore, 10 mg L-1 of BAP and 0.1 mg L-1 of NAA were added to the selenium treatments. The experiment was carried out in a completely randomized design and the tubes were kept in a growth room for 60 days. The parameters evaluated were: germination rate, seedling length, number of cladodes, number of roots and cladode length (cm). Element quantification was performed with inductively coupled plasma (ICPMS). Data were evaluated using polynomial regression curves. All statistical analyzes were performed using the R Studio software. The inclusion of sodium selenate in the culture medium provided an improvement in the germination rate, number of cladodes, cladode length and seedling length of H. costaricensis. However, with the exception of the number of cladodes, all other phylotechnical parameters evaluated appeared to have better development with estimated concentrations lower than 28 µmol L-1 (lowest concentration used), indicating that at lower doses the plants would have better development. Furthermore, the availability of selenium in the culture medium was proportional to its absorption in H. costaricensis seedlings and the addition of Se in the MS medium affected nutrient absorption by H. costaricensis.
Keywords: Selenate, Tisue culture, Pitaya.
INTRODUÇÃO
Pitaia é um termo que se refere a um grupo de espécies do gênero Hylocereus, da família Cactaceae. São plantas suculentas, trepadeira perene que é originária do sul do México e da América Central (Ibrahim et al., 2018). Nos últimos anos vem ganhando popularidade devido ao seu sabor, forma exótica e capacidade antioxidante (Tomas et al., 2023).Clique ou toque aqui para inserir o texto. As espécies mais comumente cultivadas são H. polyrhizus, H. constaricensis (casca vermelha com polpa vermelha), H. undatus (casca vermelha com polpa branca) e H. megalanthus (casca amarela com polpa branca), bem como outras variedades ou cultivares (Ruths et al., 2019).
As pitaia são propagadas comercialmente principalmente por estaquia, visto que a que a propagação assexuada proporciona características e produção uniformes, além de rapidez na produção (Ulsenheimer & Hojo, 2020). A propagação seminífera, por outro lado, tem o início da produção mais tardio, devido ao longo período juvenil, de quatro a seis anos, até atingir a maturidade necessária para o início do período reprodutivo, não é a mais indicada para cultivos comerciais (Ruths et al., 2019). Ainda há a possibilidade da reprodução sexuada que possibilita a investigação científica de fatores que afetam a biologia da germinação e proporciona a variabilidade genética necessária para a seleção de características desejáveis em um programa de melhoramento genético (Hua et al., 2015).
Para algumas espécies a germinação in vitro oferece a possibilidade do aumento na germinação das sementes, devido as condições especiais do cultivo in vitro, como controle da temperatura, luminosidade e fotoperíodo. Além do que, as plântulas adquiridas por meio desta técnica podem ser utilizadas para estudos alternativos que visem o desenvolvimento de protocolos de micropropagação clonal, para servir de base para outras técnicas biotecnológicas (Afonso et al., 2018), como a limpeza clonal, microenxertia, embriogênese somática, mutação, fusão de protoplastos e hibridação (Singh et al., 2018), além do mais, pode oferecer um sistema controlado para estudar os problemas nutricionais (Chavarriaga-Aguirre et al., 2016), fisiológicos e bioquímicos (Singh et al., 2023).
Outro ponto interessante é os aportes de elementos não essenciais as plantas (Domokos-Szabolcsy et al., 2014) durante o desenvolvimento in vitro. Entre estes elementos, pode-se destacar o Se que não é um nutriente essencial, mas em baixas doses desempenha uma importante função na proteção antioxidante das plantas, pois é componente de selenoproteínas e selenoenzimas, que desempenham importantes funções biológicas e possuem atividade antioxidante (Ramos et al., 2023), ainda promove o crescimento, aumentando a nutrição mineral e o conteúdo de pigmentos fotossintéticos e induzindo modificações morfológicas benéficas contra a toxicidade de metais pesados como o humbo (Pb) (Martins et al., 2021).
Existem várias pesquisas focadas na fertilização foliar ou solo com selênio, porém pouco se sabe sobre quanto aos seus efeitos sobre a germinação de sementes in vitro. Khai et al. (2022), constatou em seu experimento com sementes de gérbera que o Se na forma de nanopartículas de selênio (nSe), estimulou o enraizamento in vitro e o crescimento de microbrotos. São escassos os trabalhos que avaliam a taxa de germinação de sementes cultivas in vitro nutridas de selênio.
Por outro lado, existem alguns trabalhos que investigam os efeitos do selênio a partir de seu uso no tratamento de sementes. El-Badri et al. (2021), encontraram taxas de germinação maiores em sementes de Brassica napus (colza) tratadas com nanopartículas de selênio (nSe) do que o controle, além de melhoras na atividade da enzima antioxidante. Assim como Moulick et al. (2016), em seu estudo com sementes de arroz (Kranti e IR-36) sob estresse de arsênio. Por outro lado, Almeida et al. (2019) não encontraram diferença significativa entre o controle e as sementes de soja (Desafio RR) e milho (AG 1051) tratadas com Se.
O trabalho foi realizado com o objetivo avaliar os efeitos do selênio na forma de selenato de sódio (Na2SeO4) via meio de cultura na germinação, enraizamento, crescimento dos cladódios e no acúmulo de nutrientes em pitaias (Hylocereus costaricensis) cultivadas in vitro.
MATERIAL E MÉTODOS
O experimento foi conduzido no Laboratório de Cultura de Tecidos Vegetais pertencente ao Departamento de Fitotecnia da Universidade Federal do Ceará (UFC), Fortaleza – CE.
Os frutos de pitaia Hylocereus costaricensis foram coletados de plantas matrizes em área experimental do Departamento de Fitotecnia (UFC) e posteriormente levados ao Laboratório do Cultura de Tecidos Vegetais. Foram lavados com detergente neutro e enxaguados em água corrente. Com o auxílio de uma faca esterilizada foi realizado o corte para retirada da polpa e retirada das sementes com auxílio de uma peneira. Após a total retirada da polpa, restando apenas as sementes, estas foram colocadas em bandeja forradas com papel filtro para a secagem por 24 horas. Posteriormente, foram realizadas a assepsia das sementes, onde foram imersas sob agitação no álcool 70% durante um minuto, hipoclorito de sódio (2,5% de cloro ativo) por 15 minutos e por fim, a tríplice lavagem com água destilada esterilizada em câmara de fluxo laminar.
Em seguida, as sementes foram inoculadas em tubo de ensaio com 15 ml de meio de cultura MS (Murashige & Skoog, 1962), acrescido de 30 g L-1 de sacarose, 5,6 g L-1 de ágar, 10 mg L-1 de BAP (Sigma) e 0,1 mg L-1 de ANA (Sigma), posteriormente o pH foi ajustado para 5,8 ± 0,1 antes da autoclavagem a 121°C e 105 kPa por 15 minutos.
Os tratamentos foram constituídos de selênio na forma de selenato de sódio (Na2SeO4) nas concentrações: 28,0; 34,0; 40,0; 46,0; 52,0 μmol L-1 e controle (sem adição de selênio), totalizando seis tratamentos com 25 repetições, sendo cada repetição um tubo de ensaio contendo quatro sementes. O experimento foi mantido por 60 dias em sala de crescimento, com temperatura de 25 ± 1°C, fotoperíodo de 16 horas luz (lâmpada fluorescente branca) e intensidade luminosa de 52,5 W m-2 s-1.
As avaliações in vitro ocorreram a cada 7 dias (7; 14; 21; 28; 35; 42; 49 e 56 dias) após germinação, e avaliadas as seguintes características: porcentagem de germinação (%), comprimento da plântula (cm), número de cladódios, número de raízes e comprimento dos cladódios (cm), realizados com auxílio de régua graduada e paquímetro digital. Aos 60 dias, as plântulas foram retiradas dos tubos de ensaio e avaliadas quanto ao comprimento da maior raiz (cm), massa fresca e seca total (g), com auxílio de uma balança digital de precisão e, posteriormente, mantidos em estufa de circulação de ar forçada, com temperatura do ar constante em 60 ºC, por 72 horas.
A quantificação dos elementos foi realizada no Laboratório de solos da Embrapa Agroindústria Tropical, Fortaleza-CE. As amostras contendo a parte aérea e raiz foram secas e maceradas com o auxílio de cadinho e pistilo, posteriormente, separou-se as alíquotas de 0,2 g e incineradas em mufla (SolidSteel) com temperaturas entre 550-570 °C, por aproximadamente três horas. Após 24 horas, as amostras foram retiradas da mufla e filtradas com ácido nítrico, com auxílio de funil e papel filtro quantitativo faixa azul (Unifil). A determinação foi realizada por espectrometria de massa com plasma acoplado indutivamente (ICPMS – Inductively Coupled Plasma Mass Spectrometry) (Teixeira, 2017).
O experimento foi instalado em um delineamento inteiramente casualizado (DIC) com seis tratamentos, 25 repetições, sendo cada repetição constituído por um tubo de ensaio contendo quatro sementes. Os dados provenientes foram submetidos a análise de variância empregando-se o teste F. Os dados foram analisados através de curvas de regressão polinomial, para a escolha da regressão mais ajustada a significância (P≥0,05) e o coeficiente de determinação (R2) foram determinantes, utilizando o programa estatístico do software R Studio (R Core Team, 2016).
RESULTADOS E DISCUSSÃO
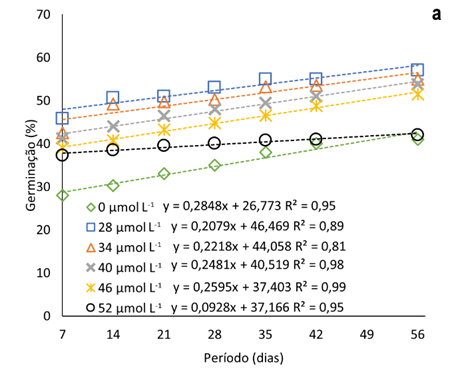
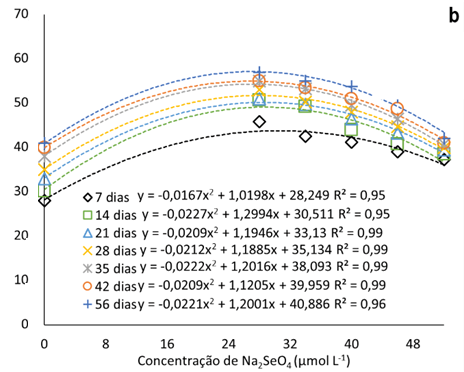
A adição de Na2SeO4 ao meio de cultura promoveu a elevação do percentual de sementes germinadas nas oito semanas avaliadas (até 56 dias) (Fig. 1a). Com a dose 52 μmol L-1 de Na2SeO4, o incremento na germinação de sementes, após a primeira semana, é menor que as demais, com média de 12% em relação a testemunha. As maiores taxas de germinação foram observadas relacionadas à dose de 28 μmol L-1 de selenato (52% em média), durante todo o período avaliado.
Figura 1
Taxa de germinação de sementes pitaias (Hylocereus costaricensis) em meio de cultura MS acrescido de selênio (selenato de sódio – Na2SeO4) em função do período avaliado (b) (7, 14, 21, 28, 34, 42 e 56 dias) e das concentrações (b) (0,0; 28,0; 34,0; 40,0; 46,0 e 52,0 μmol L-1).
|
|
|
A taxa de germinação máximas estimadas pelas equações ajustadas foi de 57% e a concentração máximas estimadas de Na2SeO4 igual a 27,2 μmol L-1 (Figura 1b), concentração menor que a menor utilizada no experimento. Observa-se que com a elevação das concentrações de Na2SeO4 no meio de cultura, a partir de 28 μmol L-1, o percentual de sementes é gradualmente menor. Tal fato pode ser decorrente da capacidade do Se, em baixas concentrações, atenuar o estresse oxidativo devido ao sistema de eliminação de ERO (espécies reativas de oxigênio).
As EROs desempenham um papel importante na regulação da dormência e germinação (Kurek et al., 2019). Em níveis baixos, são agentes sinalizadores que promovem a liberação da dormência fisiológica e desencadeia a germinação das sementes (Considine & Foyer, 2021), no entanto, em caso de excesso de ERO, há a deterioração das sementes, influenciando a peroxidação lipídica, permeabilidade da membrana, proteínas defeituosas, sistema antioxidante, degradação mitocondrial e danos ao DNA e RNA (Kurek et al., 2019).
A adição de reguladores de crescimento também pode ter melhorado a taxa de germinação. Sheng et al. (2016), estudaram a germinação de sementes de H. costaricensis em meio MS adicionado de BAP encontraram valores de germinação que chegaram a 93% com 1 ppm de BAP. Por outro lado, Mahmod et al. (2021) teve uma taxa de 100% de germinação em todos tratamentos, incluindo o controle, porém com o tratamento com 2 mg L-1 BAP em meio MS apresentando uma germinação mais rápido, 2 dias.
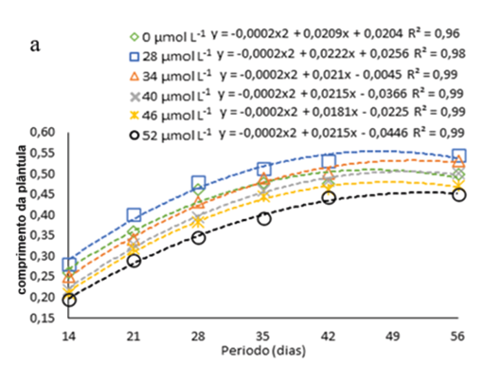
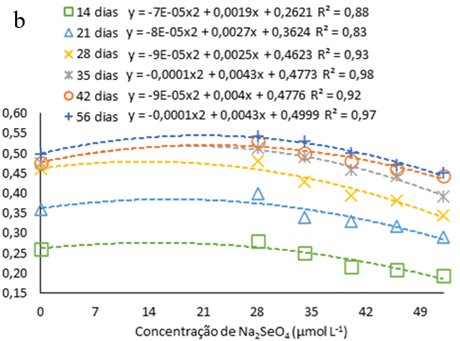
Observou-se o aumento em comprimento das plântulas de H. costaricensis ao longo do período avaliado, seguindo ajustes quadráticos, independentemente da presença ou não de Na2SeO4 ou da concentração usada no meio de cultura (Fig. 2a). Além disso, as alturas máximas estimadas pelas equações ajustadas ocorreram entre 45 e 56 dias após inoculação, independentemente da presença ou da concentração de Na2SeO4 utilizada no meio de cultura (Fig. 2a).
Figura 2
Comprimento das plântulas de s (Hylocereus costaricensis) germinadas em meio de cultura MS acrescido de selênio (selenato de sódio – Na2SeO4) em função dos períodos (a) (14, 21, 28, 34, 42 e 56 dias) e das concentrações (b) (0,0; 28,0; 34,0; 40,0; 46,0 e 52,0 μmol L-1)
|
|
|
Durante todo o período de avaliação observa-se que o aumento nas concentrações Na2SeO4 até 22 μmol L-1 (concentração máxima estimada) promoveu maior crescimento das plântulas em comprimento e, a partir desta concentração, há uma redução no comprimento das plântulas gradualmente com a elevação da concentração de Na2SeO4 no meio de cultura (figura 2b). A tendência de um maior crescimento inicial seguido por uma queda de desenvolvimento pode ser devido ao efeito tóxico induzido pela elevada concentração de Se (Cheng et al., 2023). Isso pode ser visto no trabalho de Khai et al. (2022) com gérbera (Gerbera jamesonii Bolus ex. Hook f.) cultivas in vitro com nanopartículas de selênio (nSe), no qual as plântulas atingiram a comprimento ideal na concentração de 0,7 a 1,5 mg/L, porém em concentração mais alta (3 mg L-1) a comprimento das plântulas diminuiu devido ao efeito toxico do Se.
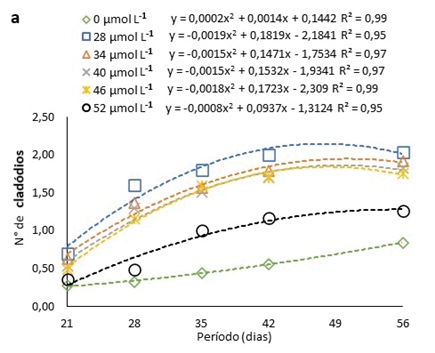
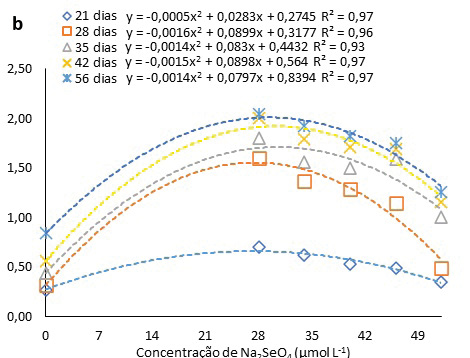
As brotações surgiram somente a partir do 21° dia após a inoculação, podendo ser observado um aumento nas brotações de H. costaricensis ao longo do período avaliado, seguindo ajustes quadráticos, independentemente da presença ou não de Na2SeO4 ou da concentração usada no meio de cultura (Fig. 3a). Além disso, o número de cladódios máximos estimados pelas equações ajustadas ocorreu entre 48 e 59 dias, após inoculação, independentemente da presença ou da concentração de Na2SeO4 utilizada no meio de cultura (Fig. 3a). O número máximo de cladódios, conforme as equações ajustadas, foi de 1,9 na concentração estimada de 30 µmol L-1 (Fig. 3a).
Figura 3
Número de cladódios em pitaias (Hylocereus costaricensis) germinadas em meio de cultura MS acrescido de selênio (selenato de sódio – Na2SeO4) em função dos períodos (a) (21, 28, 34, 41 e 56 dias) e das concentrações (b) (0,0; 28,0; 34,0; 40,0; 46,0 e 52,0 μmol L-1)
|
|
|
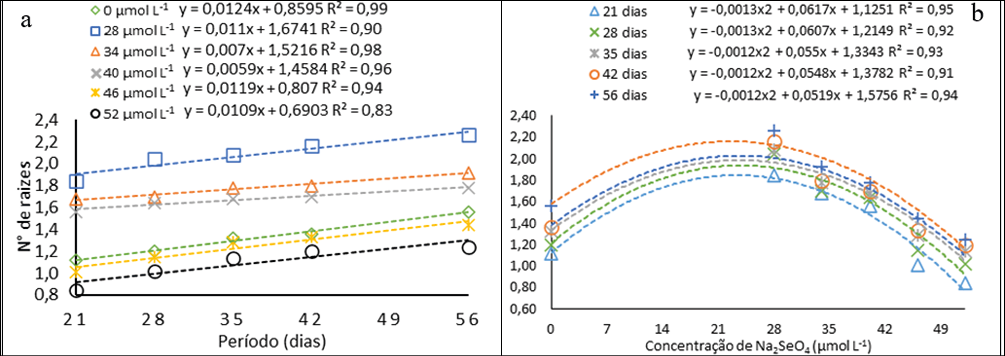
A adição de Na2SeO4 ao meio de cultura nas concentrações 28, 34 e 40 μmol L-1 promoveram a elevação no número de raízes nas oito semanas avaliadas (até 56 dias) em relação a testemunha (Fig. 4a). Aos 56 dias as plantas inoculadas sob a concentração 28 μmol L-1 apresentaram 37% mais raízes que a testemunha no mesmo período. Por meio dos ajustes quadráticos (Fig. 4b) foi possível identificar que concentrações entre 22 e 24 μmol L-1 proporcionam o maior número de raízes. O número de raízes pode também ter sido afetado pela combinação de Se e ANA (ácido naftalenoacético). A suplementação do meio MS com 50 mg L-1 nano-Se + 0,5 mg L-1 ANA alcançou os maiores valores significativos de porcentagem de enraizamento e comprimento de raiz para Phalaenopsis spp (orquídea) (Seliem et al., 2020). As auxinas agem na expansão e alongamento celular, contribuindo, também, na divisão celular, a ANA se destaca para tal finalidade (Stefanel et al., 2022).
Figura 4
Número de raízes pitaias (Hylocereus costaricensis) germinadas em meio MS acrescido de selênio (selenato de sódio Na2SeO4) em função dos períodos (a) (21, 28, 34, 41 e 56 dias) e das concentrações (b) (0,0; 28,0; 34,0; 40,0; 46,0 e 52,0 μmol L-1)
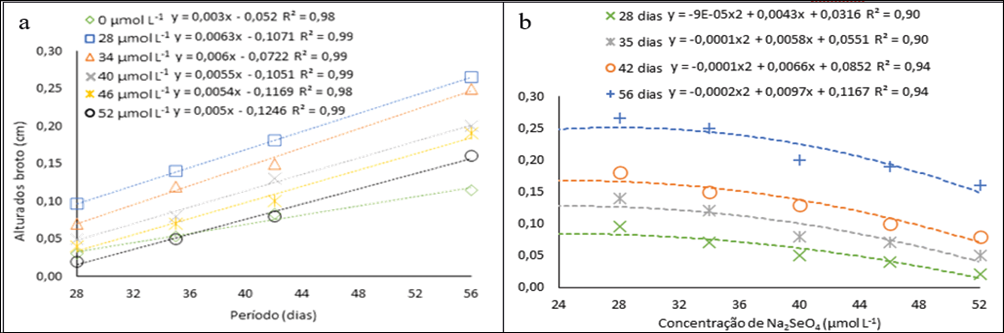
A avaliação quanto ao comprimento dos cladódios foi realizada a partir do 28° dia. A Comprimento máximo atingida foi de 0,27 cm no 56° dia na concentração de 28 µmol L-1 um valor cerca de 60% maior do que o alcançado pelo controle nesse mesmo período (Fig. 5a). Há uma diminuição gradual do comprimento dos cladódios em relação ao aumento das concentrações (Fig. 5b), por meio das equações ajustadas obteve-se o comprimento máximo de 0,23 cm na concentração estimada de 24 µmol L-1, valor menor que a menor concentração utilizada. Assim, em baixas concentrações o selênio pode estimular o desenvolvimento de algumas plantas, tal qual ocorreu com a Gérbera cultivas in vitro no estudo de Khai et al. (2022).
Figura 5
Comprimento dos cladódios de pitaias (Hylocereus costaricensis) germinadas em meio de cultura MS acrescido de selênio (selenato de sódio Na2SeO4) em função dos períodos (a) (28, 34, 41 e 56 dias) e das concentrações (b) (0,0; 28,0; 34,0; 40,0; 46,0 e 52,0 μmol L-1)
A adição de selênio no meio de cultura MS melhorou o desenvolvimento da H. costaricensis, tal fato pode ser decorrente do possível aumento da atividade da enzima nitrato redutase proporcionado pela adição de Se tal como foi relatado por alguns autores como Araújo et al. (2023) em seu estudo com cana-de-açúcar adubadas com Se. Bian et al. (2020), também encontraram resultados positivos quanto a relação entre a adição de selênio e a atividade de enzima, indicando que o selenato é eficaz na redução do nitrato através da promoção das atividades da nitrato redutase e da glutamato sintase, assim como Golubkina et al. (2018),
Além disso, estudos apontam que há uma relação entre a adição de Se e a concentração de pigmentos fotossintéticos (Araujo et al., 2023; Cabral Gouveia et al., 2020). Souza et al. (2019), cultivaram Aechmea blanchetiana (Bromeliaceae) in vitro com selênio (Na2SeO3) sub o estresse de chumbo e verificaram que a presença de Se foi fator importante na melhoria de todas as características estruturais e funcionais (fisiológicas) relacionadas ao aparato fotossintético.
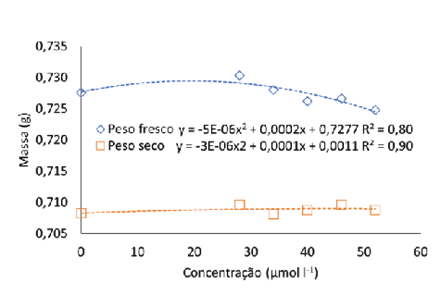
Nesse sentido, o selênio pode beneficiar o crescimento e o acúmulo de biomassa conforme as concentrações utilizadas. Khai et al. (2023), observaram em seu estudo que o conteúdo de clorofila dos cladódios de maracujá roxo (Passiflora edulis ‘Nancy Garrison’) cultivadas em meio MS com Se foi significativamente aumentada pela utilização de Se, o que eventualmente aumentou o acúmulo de biomassa. No presente trabalho valores encontrados para massa fresca e seca da plântula foram maiores na concentração de 20 e 17 µmol L-1 (respectivamente) (Fig. 6a), diminuindo com o aumento das concentrações.
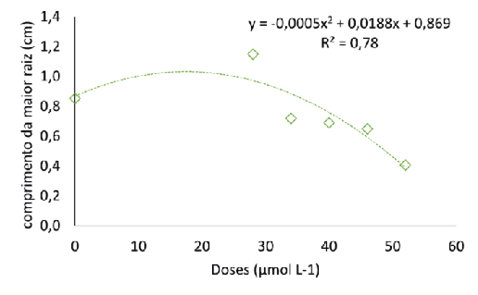
Figura 6
Massa fresca e seca (a) e comprimento da maior raiz (b) de pitaia (Hylocereus costaricensis) germinadas em meio de cultura MS acrescido de selênio na forma de selenato de sódio (Na2SeO4) em função do período das concentrações (0,0; 28,0; 34,0; 40,0; 46,0 e 52,0 μmol L-1) após 56 dias em sala de crescimento
|
|
|
A raiz é essencial no processo de absorção de água e minerais influenciando diretamente o crescimento e desenvolvimento das plantas (Cheng et al., 2023). Logo, o desenvolvimento e o rendimento da cultura estão interligados ao estado de crescimento do sistema radicular. O comprimento da maior raiz estimado foi igual a 1,05 cm na concentração estimada de 19 µmol L-1, valor 20% maior que o comprimento da maior raiz encontrado no tratamento sem Se. Em Digitalis mariana subsp. Heywoodii a ação do selênio foi similar, em baixa concentração (1 mg L-1 de selenato) aumentou o comprimento de raízes, enquanto que nas concentrações de 50 e 100 mg L-1 as plantas apresentaram sinais de toxidade (Moura et al., 2023).
As plantas têm diferentes capacidades de acumular Se nos tecidos e, em geral, baixos níveis de Se podem ter efeitos positivos na nutrição e no rendimento produtivo das culturas agrícolas. No presente estudo, observamos efeitos benéficos da complementação de Se ao meio de cultura para o crescimento e desenvolvimento in vitro de H. costaricensis, que foram refletidos pelo acúmulo significativo de Se no tecido vegetal (cladódios + cotilédones +raiz) (Fig. 7a).
Figura 7
Acúmulo de Na, Cu, Zn, B Fe e Se (a) e de P, Ca Mg, e K em pitaias (Hylocereus costaricensis) germinadas in vitro em meio MS adicionada de selenato de sódio (Na2SeO4) nas concentrações (0,0; 28,0; 34,0; 40,0; 46,0 e 52,0 μmol L-1)
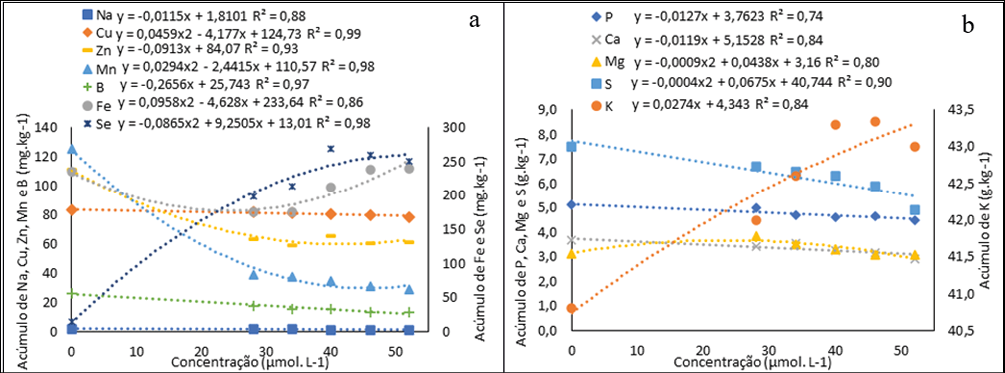
O acúmulo de Se no tecido vegetal (cladódios + cotilédones + raiz) da H. costaricensis apresentou um aumento proporcional as concentrações até a concentrações estimada pela equação quadrática de 53 μmol L-1 (260,33 mg kg-1) e a concentração 28,0 μmol L-1 apresentou o menor acúmulo (198 mg kg-1) entre os tratamentos com Se. O acúmulo de Se em plântulas de H. costaricensis cultivadas in vitro com selenato de sódio atingiu valores maiores que 100 mg kg −1, que é considerado o limite superior tolerado por plantas não acumuladoras de Se (Barillas et al., 2011), podendo ser considerada acumuladora. A Cana-do-reino (Arundo donax), assim como a H. costaricensis, foi considera acumuladora no estudo de Domokos-Szabolcsy et al. (2014), visto que foi capaz de tolerar concentração de até 5,0 mg Se kg-1 em solução nutritiva sem sofrer fitoxidade, acumulando até 1.783 μg g−1 de Se em folha.
As diferenças entre as espécies de plantas na sua capacidade de acumular Se estão geralmente associadas a diferenças no seu metabolismo secundário. Por exemplo, alliums frequentemente maiores concentrações de Se do que outras plantas, o que está relacionado com a sua capacidade de realizar a síntese de SeMeSeCys, permitindo a conversão de selenoaminoácidos potencialmente tóxicos em derivados não proteicos como MeSeCys (González-Morales et al., 2017). Da mesma forma, compostos como dimetildiseleneto (DMDSe, DMSeP e DMSe) são considerados parte de uma estratégia para aumentar a tolerância ao Se, produzindo formas voláteis de Se (White, 2018).
Em relação aos micronutrientes e ao Na, todos apresentaram diminuição na presença de Se, Fe, Zn e Mn são cofatores da SOD, assim alterações nesses nutrientes podem estar ligadas a mudanças no sistema antioxidante proporcionadas pela adição de Se (Roychowdhury et al., 2019). Além disso, a presença de Se nas plantas pode ser responsável por mudanças no coeficiente de permeabilidade iônica na membrana plasmática, modificando assim o transporte e acúmulo de micronutrientes nas células vegetais (Cipriano, Siueia Júnior, et al., ٢٠٢٢).
A presença de maiores concentrações de selenato de sódio ao meio de cultura MS favoreceu a absorção de K (Fig. 8a). Comportamento parecido foi observado em arroz (Reis et al., 2018), rabanetes (Cipriano, Siueia Júnior, et al., ٢٠٢٢) e sorgo (Cipriano, Silva, et al., 2022) biofortificados com Se. Lima et al. (2019) avaliou o crescimento e acúmulo de nutrientes em pitaias, em seu experimento o K foi o macronutriente mais demandado pelas plantas de pitaia (H. setaceus). Segundo o autor, apesar do K não fazer parte da estrutura de nenhum composto orgânico, ele é importante para as plantas por afetar a abertura e fechamento dos estômatos, a translocação de açúcares, a fotossíntese e a regulação osmótica.
Os demais macronutrientes apresentaram menor acúmulo com aumento das concentrações de selenato. Em concentrações elevados o Se pode aumentar a saturação lipídica como o efeito de uma reação de defesa das plantas sob estresse, resultando no aumento da rigidez da membrana, diminuindo permeabilidade da membrana e ocasionando a diminuição do acúmulo de macronutrientes na biomassa da planta (Filek et al., 2010).
O enxofre por outro lado, tem uma relação direta com Se. A diminuição do de enxofre (S) (Fig. 8b) devido à semelhança química entre S e Se, as plantas absorvem e metabolizam Se através da via de absorção e assimilação de S, levando a uma inibição competitiva entre Se e S (Cipriano, Silva, et al., 2022). Santiago et al. (2018) também observaram a diminuição do teor de Se quando aplicado selenato de sódio, com aumento das concentrações de S em morango (Fragaria L.).
O acúmulo de nutrientes, Na e Se no tecido vegetal (cladódios + cotilédones +raiz) da H. costaricensis ao final do período experimental apresentou a seguinte ordem decrescente: K > S > P > Ca > Mg > Fe > Se > Cu > Zn >Mn> B > Na, resultado diferente do encontrado por Lima et al. (2021) em seu estudo com Hylocereus setaceus.
CONCLUSÕES
A inclusão de selenato de sódio ao meio de cultura proporcionou melhora na taxa de germinação, número de cladódios, comprimento dos cladódios e comprimento das plântulas de H. costaricensis.
Com exceção do número de cladódios, todos os demais parâmetros filotécnicos avaliados aparentaram melhor desenvolvimento com centrações estimadas menores que a 28 µmol L-1 (menor concentração utilizada), indicando que em menores concentrações haveria um melhor desenvolvimento.
A adição de Se no meio MS afetou a absorção de nutrientes pela H. costaricensis e a disponibilidade de selênio no meio de cultura foi proporcional a sua absorção.
As conclusões deste estudo podem ser benéficas para o desenvolvimento de protocolos de uso Se na produção de Pitais e de outras culturas. O uso do Se na produção de culturas pode trazer inumes benefícios, contudo é muito importante estabelecimento de protocolos para que se indiquem doses que beneficiem as plantas sem trazer fitotoxidade.
REFERÊNCIAS
Afonso, M. V., Paranhos, J. T., Tabaldi, L. A., & Soriani, H. H. (2018). Germinação in vitro de sementes e parâmetros morfofisiológicos de microestacas de Tabernaemontana catharinensis A. DC. Iheringia, Série Botânica, 73(1), 39–45. https://doi.org/10.21826/2446-8231201873105
Almeida, J. P. M. de, Silva, J. G. da, Gomes, S. A. M., Prado, M. R. V., & Moraes, M. F. de. (2019). Selênio na germinação e desenvolvimento inicial de soja e milho. Revista Panorâmica online, 3(0). https://periodicoscientificos.ufmt.br/revistapanoramica/index.php/revistapanoramica/article/view/1098
Araujo, M. A. de, Melo, A. A. R. de, Silva, V. M., & Reis, A. R. dos. (2023). Selenium enhances ROS scavenging systems and sugar metabolism increasing growth of sugarcane plants. Plant Physiology and Biochemistry, 201, 107798. https://doi.org/10.1016/j.plaphy.2023.107798
Barillas, J. R. V., Quinn, C. F., & Pilon-Smits, E. A. H. (2011). Selenium Accumulation in Plants—Phytotechnological Applications and Ecological Implications. International Journal of Phytoremediation, 13(sup1), 166–178. https://doi.org/10.1080/15226514.2011.568542
Bian, Z., Lei, B., Cheng, R., Wang, Y., Li, T., & Yang, Q. (2020). Selenium distribution and nitrate metabolism in hydroponic lettuce (Lactuca sativa L.): Effects of selenium forms and light spectra. Journal of Integrative Agriculture, 19(1), 133–144. https://doi.org/10.1016/S2095-3119(19)62775-9
Cabral Gouveia, G. C., Galindo, F. S., Dantas Bereta Lanza, M. G., Caroline da Rocha Silva, A., Pereira de Brito Mateus, M., Souza da Silva, M., Rimoldi Tavanti, R. F., Tavanti, T. R., Lavres, J., & Reis, A. R. dos. (2020). Selenium toxicity stress-induced phenotypical, biochemical and physiological responses in rice plants: Characterization of symptoms and plant metabolic adjustment. Ecotoxicology and Environmental Safety, 202, 110916. https://doi.org/10.1016/j.ecoenv.2020.110916
Chavarriaga-Aguirre, P., Brand, A., Medina, A., Prías, M., Escobar, R., Martinez, J., Díaz, P., López, C., Roca, W. M., & Tohme, J. (2016). The potential of using biotechnology to improve cassava: a review. In Vitro Cellular & Developmental Biology – Plant, 52(5), 461–478. https://doi.org/10.1007/s11627-016-9776-3
Cheng, B., Wang, C., Yue, L., Chen, F., Cao, X., Lan, Q., Liu, T., & Wang, Z. (2023). Selenium nanomaterials improve the quality of lettuce (Lactuca sativa L.) by modulating root growth, nutrient availability, and photosynthesis. NanoImpact, 29, 100449. https://doi.org/10.1016/j.impact.2022.100449
Cipriano, P. E., Silva, R. F. da, Lima, F. R. D. de, Oliveira, C. de, Lima, A. B. de, Celante, G., Santos, A. A. dos, Archilha, M. V. L. R., Pinatto-Botelho, M. F., Faquin, V., & Guilherme, L. R. G. (2022). Selenium biofortification via soil and its effect on plant metabolism and mineral content of sorghum plants. Journal of Food Composition and Analysis, 109, 104505. https://doi.org/10.1016/j.jfca.2022.104505
Cipriano, P. E., Siueia Júnior, M., Souza, R. R., Silva, D. F., Silva, R. F., Faquin, V., Souza Silva, M. L., & Guilherme, L. R. G. (2022). Macronutrients content of radishes and the influence of biofortification with selenium. Scientia Horticulturae, 296, 110908. https://doi.org/10.1016/j.scienta.2022.110908
Considine, M. J., & Foyer, C. H. (2021). Stress effects on the reactive oxygen species-dependent regulation of plant growth and development. Journal of Experimental Botany, 72(16), 5795–5806. https://doi.org/10.1093/jxb/erab265
Domokos-Szabolcsy, É., Alla, N. A., Alshaal, T., Sztrik, A., Márton, L., & El-Ramady, H. (2014). In vitro comparative study of two Arundo donax L. ecotypes’ selenium tolerance. International Journal of Horticultural Science, 20(3-4). https://doi.org/10.31421/ijhs/20/3-4/1146
El-Badri, A. M., Batool, M., Wang, C., Hashem, A. M., Tabl, K. M., Nishawy, E., Kuai, J., Zhou, G., & Wang, B. (2021). Selenium and zinc oxide nanoparticles modulate the molecular and morpho-physiological processes during seed germination of Brassica napus under salt stress. Ecotoxicology and Environmental Safety, 225, 112695. https://doi.org/10.1016/j.ecoenv.2021.112695
Filek, M., Zembala, M., Kornaś, A., Walas, S., Mrowiec, H., & Hartikainen, H. (2010). The uptake and translocation of macro- and microelements in rape and wheat seedlings as affected by selenium supply level. Plant and Soil, 336(1-2), 303–312. https://doi.org/10.1007/s11104-010-0481-4
Golubkina, N., Kekina, H., & Caruso, G. (2018). Yield, Quality and Antioxidant Properties of Indian Mustard (Brassica juncea L.) in Response to Foliar Biofortification with Selenium and Iodine. Plants, 7(4), 80. https://doi.org/10.3390/plants7040080
González-Morales, S., Pérez-Labrada, F., García-Enciso, E., Leija-Martínez, P., Medrano-Macías, J., Dávila-Rangel, I., Juárez-Maldonado, A., Rivas-Martínez, E., & Benavides-Mendoza, A. (2017). Selenium and Sulfur to Produce Allium Functional Crops. Molecules, 22(4), 558. https://doi.org/10.3390/molecules22040558
Hua, Q., Chen, P., Liu, W., Ma, Y., Liang, R., Wang, L., Wang, Z., Hu, G., & Qin, Y. (2015). A protocol for rapid in vitro propagation of genetically diverse pitaya. Plant Cell, Tissue and Organ Culture (PCTOC), 120(2), 741–745. https://doi.org/10.1007/s11240-014-0643-9
Ibrahim, S. R. M., Mohamed, G. A., Khedr, A. I. M., Zayed, M. F., & El-Kholy, A. A.-E. S. (2018). Hylocereus: Beneficial phytochemicals, nutritional importance, and biological relevance-A review. Journal of Food Biochemistry, 42(2), e12491. https://doi.org/10.1111/jfbc.12491
Khai, H. D., Hiep, P. P. M., Tung, H. T., Phong, T. H., Mai, N. T. N., Luan, V. Q., Cuong, D. M., Vinh, B. V. T., & Nhut, D. T. (2023). Selenium nanoparticles promote adventitious rooting without callus formation at the base of passion fruit cuttings via hormonal homeostasis changes. Scientia Horticulturae, 323, 112485. https://doi.org/10.1016/j.scienta.2023.112485
Khai, H. D., Mai, N. T. N., Tung, H. T., Luan, V. Q., Cuong, D. M., Ngan, H. T. M., Chau, N. H., Buu, N. Q., Vinh, N. Q., Dung, D. M., & Nhut, D. T. (2022). Selenium nanoparticles as in vitro rooting agent, regulates stomata closure and antioxidant activity of gerbera to tolerate acclimatization stress. Plant Cell, Tissue and Organ Culture (PCTOC), 150(1), 113–128. https://doi.org/10.1007/s11240-022-02250-3
Kurek, K., Plitta-Michalak, B., & Ratajczak, E. (2019). Reactive Oxygen Species as Potential Drivers of the Seed Aging Process. Plants, 8(6), 174. https://doi.org/10.3390/plants8060174
Lima, D. de C., Mendes, N. V. B., Corrêa, M. C. de M., Taniguchi, C. A. K., Queiroz, R. F., & Natale, W. (2019). Growth and nutrient accumulation in the aerial part of red Pitaya (Hylocereus sp.). Revista Brasileira de Fruticultura, 41(5). https://doi.org/10.1590/0100-29452019030
Lima, D. de C., Mendes, N., Veloso B., Diógenes, M. F. S., Corrêa, M. C. D. M., Natale, W., & Taniguchi, C. A. K. (2021). Initial growth and nutrient accumulation in pitaya plants at different phenological stages1. Revista Caatinga, 34(3), 720–727. https://doi.org/10.1590/1983-21252021v34n324rc
Mahmod, N. H., Lema, A. A., Kamarudin, S. F., Shari, N., Abdullah, T. A., & Dogara, A. M. (2021). Effect of Plant Growth Regulators, Basal Media Strength and Carbon Sources on Hylocereus Costaricensis (Red Dragon Fruit) Seed Germination. Eurasian Journal of Science and Engineering, 7(2). https://doi.org/10.23918/eajse.v7i2p149
Martins, J. P. R., Conde, L. T., Falqueto, A. R., & Gontijo, A. B. P. L. (2021). Selenium biofortified Aechmea blanchetiana (Bromeliaceae) can resist lead-induced toxicity during in vitro culture. Acta Physiologiae Plantarum, 43(11), 149. https://doi.org/10.1007/s11738-021-03323-0
Moulick, D., Ghosh, D., & Chandra Santra, S. (2016). Evaluation of effectiveness of seed priming with selenium in rice during germination under arsenic stress. Plant Physiology and Biochemistry, 109, 571–578. https://doi.org/10.1016/j.plaphy.2016.11.004
Moura, R. C., Santos, J. P. dos, Assis, R. M. A. de, Rocha, J. P. M., Leite, J. J. F., Pereira, F. D., Bertolucci, S. K. V., & Pinto, J. E. B. P. (2023). Aplicação de fontes de selenito e selenato na micropropagação de Digitalis mariana Boiss. ssp. Heywoodii. Research, Society and Development, 12(1), e17112139703. https://doi.org/10.33448/rsd-v12i1.39703
Murashige, T., & Skoog, F. (1962). A Revised Medium for Rapid Growth and Bio Assays with Tobacco Tissue Cultures. Physiologia Plantarum, 15(3), 473–497. https://doi.org/10.1111/j.1399-3054.1962.tb08052.x
Ramos, D. P., Chan, G. A. H., Dias, M. A. R., Silva, D. V., Sousa, P. L. R., Júnior, N. R. M., Leal, T. H. V., Oliveira, W. T. M. de, Dias, D. S., Cavallini, G. S., Laia Nascimento, V. de, & Fidelis, R. R. (2023). Effect of foliar application with selenium on biofortification and physiological attributes of irrigated rice cultivars. Journal of Food Composition and Analysis, 123, 105534. https://doi.org/10.1016/j.jfca.2023.105534
Reis, H. P. G., Barcelos, J. P. de Q., Junior, E. F., Santos, E. F., Silva, V. M., Moraes, M. F., Putti, F. F., & Reis, A. R. dos. (2018). Agronomic biofortification of upland rice with selenium and nitrogen and its relation to grain quality. Journal of Cereal Science, 79, 508–515. https://doi.org/10.1016/j.jcs.2018.01.004
Roychowdhury, R., Khan, M. H., & Choudhury, S. (2019). Physiological and Molecular Responses for Metalloid Stress in Rice–A Comprehensive Overview. Em Advances in Rice Research for Abiotic Stress Tolerance (p. 341–369). Elsevier. https://doi.org/10.1016/B978-0-12-814332-2.00016-2
Ruths, R., Bonome, L. T. da S., Tomazi, Y., Siqueira, D. J., Moura, G. S., & Lima, C. S. M. (2019). Influência da temperatura e luminosidade na germinação de sementes das espécies: Selenicereus setaceus, Hylocereus undatus e Hylocereus polyrhizus. Revista de Ciências Agroveterinárias, 18(2). https://doi.org/10.5965/223811711812019194
Santiago, F. E. M., Silva, M. L. D. S., Ribeiro, F. D. O., Cipriano, P. E., & Guilherme, L. R. G. (2018). Influence of sulfur on selenium absorption in strawberry. Acta Scientiarum. Agronomy, 40(1), 35780. https://doi.org/10.4025/actasciagron.v40i1.35780
Seliem, M. K., Abdalla, N., & El-Ramady, H. R. (2020). Response of Phalaenopsis Orchid to Selenium and Bio-Nano-Selenium: In Vitro Rooting and Acclimatization. Environment, Biodiversity and Soil Security, 4(Issue 2020), 277–290. https://doi.org/10.21608/JENVBS.2020.42806.1107
Sheng, W., Sundarasekar, J., Sathasivam, K., & Subramaniam, S. (2016). Effects of plant growth regulators on seed germination and callus induction of hylocereus costaricensis. Pakistan Journal of Botany, 48(3), 977–982. http://inis.iaea.org/search/search.aspx?orig_q=RN:47116081
Singh, R., Upadhyay, A. K., & Singh, D. P. (2018). Regulation of oxidative stress and mineral nutrient status by selenium in arsenic treated crop plant Oryza sativa. Ecotoxicology and Environmental Safety, 148, 105–113. https://doi.org/10.1016/J.ECOENV.2017.10.008
Singh, Y., Kumar, U., Panigrahi, S., Balyan, P., Mehla, S., Sihag, P., Sagwal, V., Singh, K. P., White, J. C., & Dhankher, O. P. (2023). Nanoparticles as novel elicitors in plant tissue culture applications: Current status and future outlook. Plant Physiology and Biochemistry, 203, 108004. https://doi.org/10.1016/j.plaphy.2023.108004
Souza, A. F. C., Martins, J. P. R., Gontijo, A. B. P. L., & Falqueto, A. R. (2019). Selenium improves the transport dynamics and energy conservation of the photosynthetic apparatus of in vitro grown Billbergia zebrina (Bromeliaceae). Photosynthetica, 57(4), 931–941. https://doi.org/10.32615/PS.2019.105
Stefanel, C. M., Reiniger, L. R. S., Serrote, C. M. L., & Ziegler, A. C. F. (2022). Ácido naftalenoacético e cinetina na multiplicação in vitro de Eugenia involucrata. Pesquisa Florestal Brasileira, 42, 1–5. https://doi.org/10.4336/2022.pfb.42e201902079
Teixeira, F. R. M. (2017). Análise multielementar de alimentos por espetrometria de massa com plasma acoplado indutivamente. [Tese de Doutorado, Universidade de Coimbra]. https://hdl.handle.net/10316/83180
Tomas, M. da G., Rodrigues, L. J., Almeida Lobo, F. de, Takeuchi, K. P., Paula, N. R. F. de, Pinto, D. M., Nhantumbo, N., Pizzatto, M., Oualmakran, Y., Machado, G. G. L., & Boas, E. V. de B. V. (2023). Physicochemical characteristics and volatile profile of pitaya (Selenicereus setaceus). South African Journal of Botany, 154, 88–97. https://doi.org/10.1016/j.sajb.2023.01.020
Ulsenheimer, I., & Hojo, E. T. D. (2020). Mudas de pitaya propagadas em diferentes tamanhos de cladódios. Cultivo do saber, 13, 87–95. https://cultivandosaber.fag.edu.br/index.php/cultivando/article/view/999
White, P. J. (2018). Selenium metabolism in plants. Biochimica et Biophysica Acta (BBA) – General Subjects, 1862(11), 2333–2342. https://doi.org/10.1016/j.bbagen.2018.05.006