
Artigo original
PERFIL CLÍNICO-EPIDEMIOLÓGICO E ESPACIAL DA HANSENÍASE EM UMA REGIÃO DE SAÚDE, NA AMAZÔNIA BRASILEIRA
Clinical-epidemiological and spatial profile of leprosy in a health region in the Brazilian Amazon
Edlainny Araujo Ribeiro*
 Monique Valéria de Lima Carvalhal†
Monique Valéria de Lima Carvalhal† Beatriz Alves Ferraz‡
Beatriz Alves Ferraz‡
Anita Gabrielle Ferreira Teodoro§
https://doi.org/10.18593/evid.32890
Recebido em 03 de julho de 2023 | Aceito em 18 de outubro de 2023
Resumo:
Introdução: A hanseníase é uma doença infectocontagiosa, crônica, causada pelo Mycobacterium leprae prevalente no Brasil. Para que haja uma resolução holística dessa problemática é preciso considerar os preceitos de Saúde Única (One health). Objetivo: Determinar o perfil clínico-epidemiológico e espacial da hanseníase em uma região de saúde na Amazônia no período de 2012 a 2022. Materiais e Métodos: Trata-se de um estudo analítico ecológico, que utiliza dados oriundos de bases dados públicas, por meio da análise de variáveis sociodemográficas e clínicas de 15 municípios na região de saúde do Araguaia. Para a compreensão dos dados aplicou-se estatística descritiva e inferencial, bem como mapeamento geográfico. Resultados: No período de estudo, foram analisados 4346 casos de hanseníase na região de saúde analisada, o município com maior número de casos foi Redenção-PA com 22,6%. Ademais, observou-se que os casos se concentraram em homens, adultos, pardos e com baixa escolaridade. Além disso, a forma clínica mais prevalente foi a Dimorfa, 51,9%, a classificação multibacilar, 79,3% e o esquema terapêutico mais utilizado foi a poliquimioterapia multibacilar de doze doses, 78%. Outras observações importantes foram a baixa adesão à realização de baciloscopia, redução no número de casos a partir de 2020 e poucos registros na população indígena. Conclusão: Portanto, nota-se que há necessidade de ampliação das medidas de vigilância e de controle da hanseníase, com ênfase no diagnóstico, rastreio e notificação dos casos, a fim de, com isso, obter informações essenciais para a elaboração de estratégias locais assertivas, que visem o controle, mitigação dos casos e redução dos prejuízos à saúde dos indivíduos acometidos.
Palavras-chave: Estratégias de saúde. Hanseníase. Mapeamento geográfico. Monitoramento epidemiológico. Saúde única.
@Autor correspondente: Mestre em Ciências Ambientais e Saúde (Pontifícia Universidade Católica de Goiás); Doutoranda em infectologia (Universidade Federal de São Paulo). Faculdade de Ensino Superior da Amazônia Reunida, Avenida Brasil, nº 1435, Alto Paraná, Redenção-PA; https://orcid.org/0000-0001-6935-3400; dyy_araujo77@hotmail.com.
Abstract:
Introduction: Leprosy is a chronic infectious disease caused by Mycobacterium leprae prevalent in Brazil. In order for there to be a holistic resolution of this problem, it is necessary to consider the precepts of One Health. Objective: To determine the clinical-epidemiological and spatial profile of leprosy in a health region in the Amazon between 2012 and 2022. Materials and Methods: This is an ecological analytical study, which uses data from public databases, through analysis of sociodemographic and clinical variables from 15 municipalities in the Araguaia health region. To understand the data, descriptive and inferential statistics were applied, as well as geographic mapping. Results: During the study period, 4346 cases of leprosy were analyzed in the health region analyzed, the municipality with the highest number of cases was Redenção-PA with 22.6%. Furthermore, it was observed that the cases were concentrated in men, adults, mixed race and with low education. Furthermore, the most prevalent clinical form was Dimorfa, 51.9%, the multibacillary classification, 79.3% and the most used therapeutic regimen was multibacillary multidrug therapy with twelve doses, 78%. Other important observations were the low adherence to smear microscopy, a reduction in the number of cases from 2020 onwards and few records in the indigenous population. Conclusion: Therefore, it is noted that there is a need to expand leprosy surveillance and control measures, with an emphasis on diagnosis, tracking and notification of cases, in order to obtain essential information for the development of assertive local strategies, which aim to control, mitigate cases and reduce damage to the health of affected individuals.
Keywords: Epidemiological monitoring. Geographic mapping. Health strategies. Leprosy. One health.
1 INTRODUÇÃO
A hanseníase é uma doença infectocontagiosa de caráter crônico, causada pelo Mycobacterium leprae, também conhecido como bacilo de Hansen1-2. Trata-se de um patógeno intracelular obrigatório que possui predileção em acometer pele e nervos periféricos – sobretudo as células de Schwann –, pois causam comprometimento neurológico periférico e contribui para incapacidades funcionais permanentes3.
Em decorrência à relevância da hanseníase como problema de saúde pública brasileira, foi lançado em 2010 o Programa Nacional de Controle da Hanseníase do Ministério da Saúde, no qual se preconizou que as ações de controle da doença fossem descentralizadas para Atenção Primária em Saúde e coordenadas pela Estratégia de Saúde da Família (ESF). Com o fito de, assim, facilitar o acesso aos serviços como vacinação e diagnóstico precoces e assim reduzir os níveis endêmicos da doença4.
Entretanto, de acordo com a Organização Mundial da Saúde (OMS), em 2020 o Brasil ocupou o segundo lugar em incidência de hanseníase no mundo, com 17.979 casos notificados da doença no país, o que considerou, assim, a área de alta endemicidade5. Nesse sentido, ressalta-se que, em locais com maior endemicidade, observa-se mais condições precárias de caráter socioeconômico e de saúde2,6.
Dessa forma, para que haja uma resolução holística dessa problemática é preciso considerar os preceitos de Saúde Única, em uma abordagem colaborativa, multissetorial e transdisciplinar – a fim de trabalhar nos níveis local, regional e global – com o objetivo de alcançar resultados de saúde ideais que reconheçam a interconexão entre pessoas, animais, plantas e seu ambiente compartilhado7. Isso foi demonstrado na Nigéria, em que a aplicação de abordagens de Saúde Única (One health), culminou na eliminação do vírus H5N1 da gripe aviária altamente patogênico em 20068.
Diante do exposto e ao considerar o impacto dessa patologia na região amazônica, este estudo é de grande valia, visto que apresenta uma compilação de dados acerca da hanseníase em seus aspectos clínico, epidemiológico e espacial. Além disso, poderá embasar políticas de saúde pública locais – por meio do conhecimento acerca da distribuição espacial da doença na região – e nortear ações ou intervenções assertivas para o combate à disseminação da infecção na região.
Em suma, a presente pesquisa teve como objetivo descrever o perfil clínico-epidemiológico e espacial da hanseníase em uma região de saúde na Amazônia brasileira.
2 MATERIAIS E MÉTODOS
2.1 TIPO E LOCAL DE ESTUDO
Este é um estudo analítico ecológico com abordagem quantitativa. Para a realização deste estudo utilizou-se dados provenientes de 15 municípios pertencentes 12º Centro Regional de Saúde (Região do Araguaia), localizados no Sudeste do Estado do Pará na Amazônia brasileira: Redenção, Rio Maria, Bannach, Conceição do Araguaia, Sapucaia, Tucumã, Xinguara, Pau D’Arco, Floresta do Araguaia, Ourilândia do Norte, São Félix do Xingú, Cumaru do Norte, Santana do Araguaia, Água Azul do Norte e Santa Maria das Barreiras. Essa região apresenta densidade populacional de aproximadamente 583.777 habitantes, bioma amazônico que sofre de maneira intensa com o desmatamento, que alcança níveis estimados de 22,54% da área total do estado do Pará até o ano de 20219.
2.2 COLETA E ANÁLISE DE DADOS
Os dados clínico-epidemiológicos referentes aos casos de hanseníase foram coletados no banco de dados do Departamento de Informática do Sistema Único de Saúde (Data-SUS-TABNET), na plataforma do Sistema de Informação de Agravos de Notificação (SINAN), disponíveis de 2012 a 2022. Analisou-se as seguintes variáveis disponíveis no SINAN: ano de notificação, faixa etária, sexo, escolaridade, raça, forma clínica de notificação, tipo de lesões cutâneas, realização de baciloscopia, classificação, esquema terapêutico e tipos de saída no período de 2012 a 2022. As coletas dos dados ocorreram no período de janeiro a fevereiro de 2023.
Para análise estatística inferencial foi utilizado o software BioEstat, versão 5.3. Realizou-se teste G para testar associação entre as diferentes categorias de uma variável em grupos independentes, considerou-se nível de significância estatística de p<0,05.
Para entender a associação entre o número de casos e as variáveis sexo (masculino e feminino); idade (nas faixas etárias 1 a 14, 15 a 19, 20 a 59 e maiores de 60 anos de idade); raça (branco, preta, amarelo, indígena e sem resposta); escolaridade (ensino fundamental incompleto, fundamental completo, ensino médio incompleto, ensino médio completo, ensino superior e sem resposta); a forma clínica do número de casos (indeterminada, tuberculóide, dimorfa, Virchowiana e não classificada); o resultado da baciloscopia (positivo, negativo e não realizado); o esquema terapêutico (Poliquimioterapia-PQT de 6 doses, de 12 doses e outros esquemas) e os tipos de saída (não preenchidas, transferência, cura, abandono e erro de diagnóstico) foi calculado o coeficiente de correlação de postos de Spearman. Para isso foi utilizado o software BioEstat, versão 5.3.
Para realização da análise espacial, os dados foram plotados em um arquivo vetorial do tipo ponto, em formato shape, com Sistema de Referência de Coordenadas planas em UTM SIRGAS 2000. Em seguida, com o objetivo de alcançar uma melhor espacialização dentro do município, foi gerada uma malha pontos, com 20 km de distância cada, além de atribuídos os dados de óbitos por hanseníase a partir de sua localidade municipal.
Posteriormente, foi utilizado o estimador de densidade kernel, contido na ferramenta “Mapa de Calor” do QGIS, em que há função quártica, com um raio de 30 km e peso atribuído ao número de óbitos. Após a geração do mapa contendo as regiões de concentração, foi realizada a reclassificação dos dados raster gerados com base na renderização da banda da imagem na opção banda simples falsa-cor, para que se categorizasse em cinco classes: ausente (verde escuro), baixa (verde claro), média (amarelo), alta (laranja) e muito alta (vermelho). Com relação à frequência de hanseníase por município, para a classificação, foi utilizada a função de quebras naturais (Jenks), pois ela utiliza um algoritmo que busca uma minimização da variância dentro do grupo – uma vez que os valores não são igualmente distribuídos, essa função resulta em classes mais balanceadas.
2.3 ASPECTOS ÉTICOS
Por se tratar de uma pesquisa com dados secundários públicos (DATASUS-SINAN), este estudo não foi submetido ao Comitê de Ética em pesquisa, atendendo a resolução do Conselho Nacional de Saúde nº 466, de 12 dezembro 2012 e dispensa assinatura do Termo de Consentimento Livre Esclarecido (TCLE).
3 RESULTADOS
Para o período analisado (2012-2022) foram registrados 4346 casos de hanseníase na região de saúde em estudo, com maior concentração de casos nos municípios de Redenção-PA que deteve 22,6% dos casos, seguida por São Félix do Xingu-PA com 14,3% e Xinguara-PA com 13,5%, a distribuição espacial completa é apresentada na Figura 1 e Tabela 1. Devido à distribuição temporal, foi possível evidenciar que o ano com maior número de notificações da doença foi 2012, já que apresentou 12,6%, seguido pelo ano 2019, com 11,7% dos casos. No entanto, a partir de 2020 as notificações de casos reduziram (Figura 2).
A partir da análise das variáveis sociodemográficas, notou-se que os casos se concentraram em indivíduos do sexo masculino com 63,9%, na faixa etária adulta de 20-59 anos com 67,4%; raça parda com 67,4% e com ensino fundamental incompleto – o que representou 61,0% das notificações. Entretanto, por meio das análises inferenciais, observou-se que as correlações na sua maioria foram altas, positivas e significativas para todas as variáveis sociodemográficas (Tabela 1).
De forma global, ao analisar as associações entre os dados de todos os municípios e o sexo dos pacientes foram observadas correlações altas (0,99 para o sexo masculino e 0,98 para o sexo feminino) e significativas (p<0,01). Isso evidenciou que a hanseníase é uma doença que acomete ambos os sexos. Da mesma forma, percebeu-se correlações altas e significativas (p<0,01) entre os números de casos e todas as faixas etárias analisadas. Com coeficiente igual a 0,90 para a faixa etária de 1 a 14 anos igual; 0,87 para a faixa de 15 a 19 anos; 0,99 na faixa etária de 20 a 59; e 0,93 para a faixa de maiores de 60 anos de idade (Tabela 1).
Com relação à raça, foram encontradas conexões significativas (p<0,01) em todas as classificações analisadas. No entanto, só foi encontrada uma correlação baixa (0,36) entre o número de casos e a raça indígena. Para as outras raças estudadas, os coeficientes encontrados foram altos: branca (0,92), preta (0,94) e parda (0,98) (Tabela 1).
Quanto às características clínicas, notou-se que a forma clínica mais prevalente foi a Dimorfa com 51,9% seguida pelas formas Indeterminada com 16,3% e Virchowiana com 12,2%. Além disso, observou-se com maior frequência a presença de pacientes com mais de 5 lesões (37,8%) e com a classificação Multibacilar (79,3%). Os coeficientes de correlação encontrados mostraram associações significativas (p<0,01) para todas as formas. Contudo, para as formas Indeterminadas (0,77) e Tuberculoide (0,76) os valores representam uma relação média. E para as formas Dimorfa (0,98) e Virchowiana (0,96) elevados (Tabela 2).
Diante disso, na confirmação laboratorial, observou-se uma baixa adesão à baciloscopia, que não foi realizada em 45,3% dos casos. O tratamento mais realizado nos casos de hanseníase foi o esquema PQT Multibacilar (PQT-MB) de doze doses (78%). Foram observadas, ainda, correlações altas e significativas (p<0,01) para os esquemas terapêuticos de 6 doses (0,88) e 12 doses (0,98) (Tabela 2).
Assim, sobre a evolução dos casos, observou-se que o principal desfecho foi a cura em 69,5%. Com correlação alta em relação ao número de casos (0,98 p<0,01). Quanto à frequência de erros diagnósticos – que são aqueles nos quais o diagnóstico é considerado inadequado –, verificou-se que eles ocorreram em 1% dos casos, com predomínio no município de Redenção-PA, 32,6%; Xinguara-PA, 29,9%; São Félix do Xingu-PA, 11,6% respectivamente. O Coeficiente de correlação significativo é de 0,77 entre o número de casos e o erro de diagnóstico (Tabela 2).
Com relação ao perfil espacial de distribuição dos óbitos (n=52), as cidades com maior frequência foram Redenção-PA e Xinguara-PA, ambas com 17,3% (Figura 1). Ademais, observou-se que eles ocorreram predominante em indivíduos do sexo masculino (84,6%), com baixa escolaridade (34,6%), na faixa etária de 20 a 59 anos (48,1%), pardos (55,8%), acometidos pela forma clínica multibacilar (98,1%).
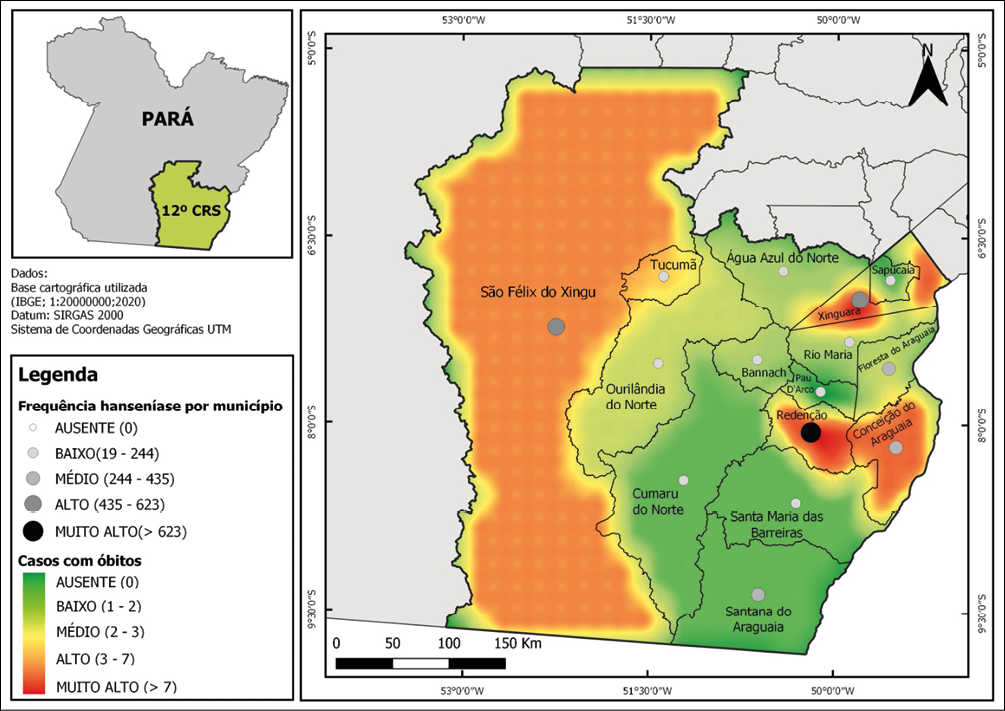
Figura 1 – Distribuição espacial dos casos e óbitos associados à hanseníase em uma região de saúde, no Sudeste do Pará, Brasil de 2012 a 2022.
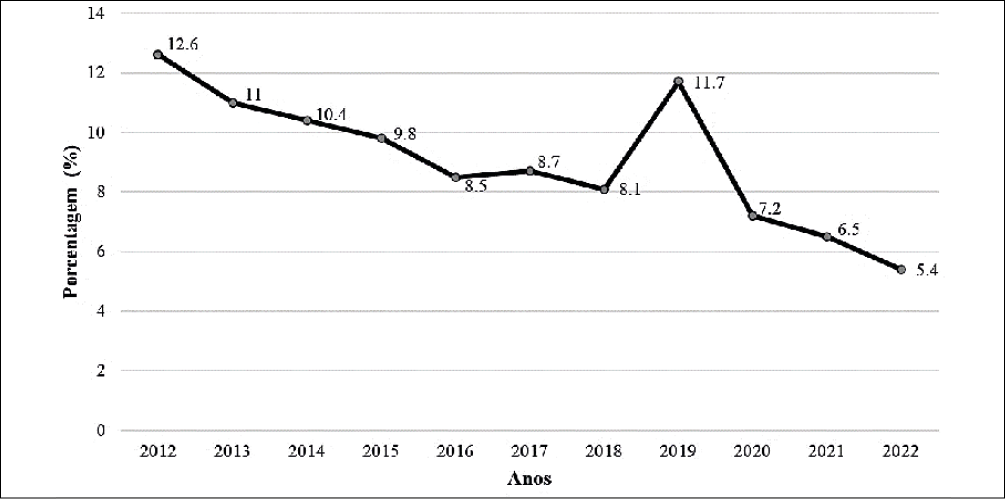
Figura 2 – Distribuição de casos notificados de hanseníase em uma região de saúde no período de 2012 a 2022, Pará, Brasil.
Tabela 1 – Perfil epidemiológico dos casos de Hanseníase em uma região de saúde no período de 2012 a 2022 no Sudeste do Pará, Brasil.
|
Variáveis analisadas |
Municípios n (%) |
||||||||||||||
|
AAN n=107 |
B n=19 |
CA n=435 |
CN n=70 |
FA n=358 |
ON n=244 |
PD n=36 |
R n=983 |
RM n=163 |
SMB n=141 |
SA n=309 |
SFX n=623 |
S n=54 |
T n=213 |
X n=590 |
|
|
Sexo (p= 0,000)* |
|||||||||||||||
|
Masculino |
80 (74,8) |
14 (73,7) |
268 (61,6) |
48 (68,6) |
202 (56,4) |
168 (68,9) |
18 (48,6) |
604 (61,4) |
106 (75,2) |
106 (75,2) |
205 (66,3) |
404 (64,8) |
43 (79,6) |
158 (74,2) |
354 (60) |
|
Feminino |
27 (25,2) |
5 (26,3) |
167 (38,4) |
22 (31,4) |
156 (43,6) |
76 (31,1) |
19 (51,4) |
378 (38,5) |
57 (34,8) |
35 (24,8) |
104 (33,7) |
218 (35) |
11 (20,4) |
55 (25,8) |
236 (40) |
|
Ignorado |
- |
- |
- |
- |
- |
- |
- |
1 (0,1) |
- |
- |
- |
1 (0,2) |
- |
- |
- |
|
Faixa Etária (p<0,000)* |
|||||||||||||||
|
1 a 14 anos |
7 (6,5) |
- |
33 (7,6) |
7 (10) |
29 (8,1) |
19 (7,8) |
4 (10,8) |
94 (9,6) |
14 (8,6) |
8 (5,7) |
49 (15,9) |
82 (13,2) |
1 (1,8) |
5 (2,4) |
71 (12) |
|
15-19 anos |
6 (5,6) |
- |
25 (5,8) |
1 (1,4) |
29 (8,1) |
21 (8,6) |
3 (8,1) |
45 (4,6) |
4 (2,4) |
5 (3,5) |
18 (5,8) |
37 (5,9) |
3 (5,6) |
6 (2,8) |
45 (7,6) |
|
20-59 |
70 (65,4) |
15 (78,9) |
282 (64,8) |
50 (71,4) |
238 (66,5) |
162 (66,4) |
27 (73) |
683 (69,4) |
104 (63,8) |
101 (71,6) |
192 (62,1) |
413 (66,3) |
40 (74,1) |
154 (72,3) |
402 (68,2) |
|
>60 |
24 (22,4) |
4 (21,1) |
95 (21,8) |
12 (17,1) |
62 (17,3) |
42 (17,2) |
3 (8,1) |
161 (16,4) |
41 (25,2) |
27 (19,2) |
50 (16,2) |
91 (14,6) |
10 (18,5) |
48 (22,5) |
72 (12,2) |
|
Raça (p<0,000)* |
|||||||||||||||
|
Ignorado |
6 (5,6) |
1 (5,3) |
35 (8) |
- |
2 (0,5) |
11 (4,5) |
2 (5,4) |
9 (0,9) |
1 (0,6) |
2 (1,4) |
3 (0,9) |
2 (0,3) |
3 (5,6) |
10 (4,7) |
8 (1,4) |
|
Branco |
20 (18,7) |
3 (15,8) |
54 (12,4) |
14 (20) |
64 (17,9) |
69 (28,3) |
5 (13,5) |
148 (15,1) |
19 (11,7) |
2 (1,4) |
38 (12,3) |
101 (16,2) |
8 (14,8) |
37 (17,4) |
97 (16,4) |
|
Preta |
12 (11,2) |
5 (26,3) |
66 (15,2) |
13 (18,6) |
44 (12,2) |
55 (22,5) |
8 (21,6) |
142 (14,4) |
23 (14,1) |
1 (0,7) |
41 (13,3) |
73 (11,7) |
7 (13) |
35 (16,4) |
96 (16,3) |
|
Pardo |
67 (62,6) |
10 (52,6) |
280 (64,4) |
43 (61,4) |
248 (69,3) |
109 (44,7) |
22 (59,5) |
678 (69) |
120 (73,6) |
131 (93) |
225 (72,8) |
443 (71,1) |
36 (66,6) |
131 (61,5) |
388 (65,8) |
|
Indígena |
2 (1,9) |
- |
- |
- |
- |
- |
- |
6 (0,6) |
- |
5 (3,5) |
2 (0,6) |
4 (0,6) |
- |
- |
1 (0,1) |
|
Escolaridade (p<0,000)* |
|||||||||||||||
|
Ignorado |
43 (40,2) |
4 (21) |
129 (29,7) |
9 (12,9) |
44 (12,) |
95 (38,9) |
9 (24,3) |
86 (8,7) |
41 (25,1) |
86 (61) |
45 (14,6) |
61 (9,8) |
23 (42,6) |
52 (24,4) |
75 (12,7) |
|
Fundamental incompleto |
55 (51,4) |
9 (47,4) |
224 (51,5) |
49 (70,0) |
233 (65,1) |
109 (44,7) |
18 (48,6) |
697 (70,9) |
91 (55,8) |
47 (33,3) |
198 (64,1) |
412 (66,1) |
24 (44,4) |
121 (56,8) |
363 (61,5) |
|
Fundamental Completo |
4 (3,7) |
- |
17 (3,9) |
4 (5,7) |
26 (7,3) |
6 (2,5) |
1 (2,7) |
43 (4,4) |
5 (3,7) |
5 (3,5) |
21 (6,8) |
36 (5,8) |
2 (3,7) |
3 (1,4) |
33 (5,6) |
|
Médio Incompleto |
- |
3 (15,8) |
19 (4,4) |
3 (4,3) |
22 (6,1) |
18 (7,4) |
2 (5,4) |
48 (4,9) |
11 (6,7) |
1 (0,7) |
23 (7,4) |
39 (6,3) |
4 (7,4) |
14 (6,6) |
35 (5,9) |
|
Médio Completo |
2 (1,9) |
2 (10,5) |
38 (8,7) |
4 (5,7) |
30 (8,4) |
13 (5,3) |
5 (13,5) |
87 (8,9) |
14 (8,6) |
2 (1,4) |
17 (5,5) |
60 (9,6) |
- |
18 (8,5) |
67 (11,3) |
|
Ensino Superior |
3 (2,8) |
1 (5,3) |
8 (1,8) |
1 (1,4) |
3 (0,8) |
3 (1,2) |
2 (5,4) |
22 (2,2) |
1 (0,6) |
- |
5 (1,6) |
15 (2,4) |
1 (1,8) |
5 (2,3) |
17 (2,9) |
|
*Teste g; () Dados numéricos demonstrados em porcentagem. Dado numérico igual a zero. AAN= Água Azul do Norte B= Bannach CA= Conceição do Araguaia CN= Cumaru do Norte ON= Ourilândia do Norte PD= Pau D´arco R= Redenção RM= Rio Maria SMB= Santa Maria das Barreiras SA= Santana do Araguaia SFX= São Félix do Xingu S= Sapucaia T= Tucumã X= Xinguara FA= Floresta do Araguaia |
|||||||||||||||
Tabela 2 – Perfil clínico dos casos de Hanseníase em uma região de saúde no período de 2012 a 2022 no Sudeste do Pará, Brasil.
|
Variáveis analisadas |
Municípios n (%) |
||||||||||||||
|
AAN n=107 |
B n=19 |
CA n=435 |
CN n=70 |
FA n=358 |
ON n=244 |
PD n=36 |
R n=983 |
RM n=163 |
SMB n=141 |
SA n=309 |
SFX n=623 |
S n=54 |
T n=213 |
X n=590 |
|
|
Forma clínica (p<0,000)* |
|||||||||||||||
|
Ignorado |
21 (19,6) |
1 (5,3) |
38 (8,7) |
3(4,3) |
7 (2) |
34 (13,9) |
6 (16,2) |
4 (0,4) |
15 (9,2) |
26 (18,4) |
5 (1,6) |
16 (2,5) |
8 (14,8) |
12 (5,6) |
13 (2,2) |
|
Indeterminada |
19 (17,8) |
8 (42,1) |
65 (14,9) |
25(35,7) |
100 (27,9) |
26 (10,7) |
16 (43,2) |
107 (10,9) |
37 (22,7) |
6 (4,3) |
60 (19,4) |
91(14,6) |
8 (14,8) |
27 (12,7) |
113 (19,1) |
|
Tuberculoide |
2 (1,9) |
- |
69 (15,9) |
12(17,2) |
32 (8,9) |
15 (6,1) |
2 (5,4) |
81 (8,2) |
24 (14,7) |
9 (6,4) |
19 (6,1) |
35 (5,6) |
4 (7,4) |
7 (3,3) |
33 (5,6) |
|
Dimorfa |
38 (35,5) |
2 (10,5) |
169 (38,9) |
18(25,7) |
170 (47,5) |
105 (43) |
9 (24,3) |
646 (65,7) |
34 (20,9) |
24 (17) |
166 (53,7) |
373 (59,8) |
21 (38,9) |
123 (57,7) |
358 (60,7) |
|
Virchowiana |
14 (13,1) |
1 (5,3) |
32 (7,4) |
8(11,4) |
33 (9,2) |
18 (7,4) |
4 (10,8) |
129 (13,1) |
26 (16) |
27 (19,1) |
57 (18,5) |
96 (15,4) |
7 (13) |
14 (6,6) |
66 (11,1) |
|
Não classificada |
13 (12,1) |
7 (36,8) |
62 (14,2) |
4(5,7) |
16 (45) |
46 (18,9) |
- |
16 (1,6) |
27 (16,6) |
49 (34,8) |
2 (0,6) |
14 (2,2) |
6 (11,1) |
30 (14,1) |
7 (1,2) |
|
Baciloscopia (p<0,000)* |
|||||||||||||||
|
Ignorado |
13 (12,1) |
1 (5,3) |
58 (13,3) |
3 (4,3) |
6 (1,7) |
20 (8,2) |
7 (18,9) |
29 (2,9) |
17 (10,4) |
18 (12,8) |
15 (4,9) |
14 (2,3) |
6 (11,1) |
18 (8,5) |
31 (5,3) |
|
Positivo |
35 (32,7) |
3 (15,8) |
72 (16,6) |
32 (45,7) |
204 (57) |
104 (42,6) |
8 (21,6) |
161 (16,4) |
47 (28,8) |
67 (47,5) |
39 (12,6) |
248 (39,8) |
17 (31,5) |
126 (59,1) |
70 (11,9) |
|
Negativo |
27 (25,2) |
4 (21) |
127 (29,2) |
9 (12,9) |
100 (27,9) |
73 (29,9) |
3 (8,1) |
185 (18,8) |
43 (26,4) |
15 (10,6) |
17 (5,5) |
113 (18,1) |
12 (22,2) |
47 (22,1) |
113 (19,1) |
|
Não realizado |
32 (30) |
11 (57,9) |
178 (40,9) |
26 (37,1) |
48 (13,4) |
47 (19,3) |
19 (51,4) |
608 (61,9) |
56 (34,4) |
41 (29,1) |
238 (77) |
248 (39,8) |
19 (35,2) |
22 (10,3) |
376 (63,7) |
|
Classificação (p<0,000)* |
|||||||||||||||
|
Paucibacilar |
16 (15) |
7 (36,8) |
144 (33,1) |
18 (25,7) |
93 (26) |
44 (18) |
9 (24,3) |
160 (16,3) |
37 (22,7) |
18 (12,8) |
67 (21,7) |
127 (20,4) |
11 (20,4) |
26 (12,2) |
122 (20,7) |
|
Multibacilar |
91 (85) |
12 (63,2) |
291 (66,9) |
52 (74,3) |
265 (74) |
200 (82) |
28 (75,7) |
823 (83,7) |
126 (77,3) |
123 (87,2) |
242 (78,3) |
496 (79,6) |
43 (79,6) |
187 (87,8) |
468 (79,3) |
|
Esquema terapêutico (p<0,000)* |
|||||||||||||||
|
Ignorado |
1 (0,9) |
- |
1 (0,2) |
- |
- |
1 (0,4) |
- |
- |
- |
- |
- |
- |
- |
- |
1 (0,2) |
|
PQT-PB 6 doses |
14 (13,1) |
7 (36,8) |
145 (33,3) |
22 (31,4) |
98 (27,4) |
47 (19,3) |
9 (24,3) |
169 (17,2) |
38 (23,3) |
19 (13,5) |
71 (23) |
125 (20,1) |
13 (24,1) |
30 (14,1) |
133 (22,5) |
|
PQT-MB 12 dose |
92 (86) |
12 (63,2) |
289 (66,4) |
48 (68,6) |
260 (72,6) |
196 (80,3) |
27 (73) |
808 (82,2) |
124 (76) |
121 (85,8) |
238 (77) |
498 (79,9) |
41 (75,9) |
183 (85,9) |
455 (77,1) |
|
Outros esquemas |
- |
- |
- |
- |
- |
- |
1 (2,7) |
6 (0,6) |
1 (0,6) |
1 (0,7) |
- |
- |
- |
- |
1 (0,2) |
|
Tipos de saída (p<0,000)* |
|||||||||||||||
|
Não preenchido |
15 (14) |
- |
20 (4,6) |
12 (17,1) |
31 (8,7) |
24 (9,8) |
2 (5,5) |
53 (5,4) |
13 (8) |
23 (16,3) |
18 (5,8) |
50 (8) |
26 (48,1) |
18 (8,5) |
41 (6,9) |
|
Cura |
70 (65,4) |
14 (73,7) |
330 (75,9) |
34 (48,6) |
277 (77,4) |
154 (63,1) |
29 (78,4) |
705 (71,7) |
123 (75,4) |
98 (69,5) |
239 (77,4) |
381 (61,2) |
9 (16,7) |
143 (67,1) |
417 (70,7) |
|
Transferência |
8 (7,5) |
1 (5,3) |
38 (8,7) |
11 (15,7) |
27 (7,5) |
40 (16,4) |
- |
81 (8,2) |
19 (11,7) |
6 (4,3) |
16 (5,2) |
61 (9,8) |
2 (3,7) |
19 (8,9) |
54 (9,2) |
|
Óbito |
2 (1,9) |
2 (10,5) |
7 (1,6) |
1 (1,4) |
3 (0,8) |
3 (1,2) |
- |
9 (0,9) |
2 (1,2) |
1 (0,7) |
1 (0,3) |
6 (0,9) |
1 (1,9) |
5 (2,4) |
9 (1,5) |
|
Abandono |
10 (9,3) |
2 (10,5) |
36 (8,3) |
12 (17,1) |
20 (5,6) |
21 (8,6) |
6 (16,1) |
121 (12,3) |
6 (3,7) |
13 (9,2) |
34 (11) |
120 (19,3) |
13 (24,1) |
25 (11,7) |
60 (10,2) |
|
Erro diagnóstico |
2 (1,9) |
- |
4 (0,9) |
- |
- |
2 (0,8) |
- |
14 (1,4) |
- |
- |
1 (0,3) |
5 (0,8) |
3 (5,5) |
3 (1,4) |
9 (1,5) |
|
*Teste g; () Dados numéricos demonstrados em porcentagem. Dado numérico igual a zero. AAN= Água Azul do Norte B= Bannach CA= Conceição do Araguaia CN= Cumaru do Norte ON= Ourilândia do Norte PD= Pau D´arco R= Redenção RM= Rio Maria SMB= Santa Maria das Barreiras SA= Santana do Araguaia SFX= São Félix do Xingu S= Sapucaia T= Tucumã X= Xinguara FA= Floresta do Araguaia PQT-PB= Poliquimioterapia Paucibacilar PQT-MB= Poliquimioterapia Multibacilar. |
|||||||||||||||
4 DISCUSSÃO
A magnitude da hanseníase na região de saúde do Araguaia é evidente, mesmo que existam programas para controle e mitigação dos casos, essa patologia ainda se faz presente e causa prejuízos à saúde2,4. É preciso destacar que o Estado do Pará apresenta um dos piores índices de desenvolvimento humano (IDH), pois foi considerado o 23º em 2021, com o índice de 0,690 – o que pode explicar a constância e persistência dessa problemática nesta região4,10.
De acordo com uma revisão sistemática, existem relações consistentes entre a hanseníase e condições socioeconômicas desfavoráveis. Dessa forma, tal patologia foi incluída na carteira de doenças que estão associadas à pobreza10. Além disso, a região em estudo está localizada na Amazônia brasileira que apresenta clima tropical úmido, e é frequentemente afetada pela degradação progressiva da floresta e contaminação dos rios, oriundas das intervenções inapropriadas humanas. Isso pode facilitar a evolução de patógenos e propagação de doenças em nível local e globalmente11-14.
Nesse sentido, essas modificações podem influenciar a dinâmica de transmissão da hanseníase associada ao ambiente e isso está relacionado à intensidade de exposição do indivíduo ao solo e água contaminados, às atividades de caça e ao consumo de animais silvestres com frequência15. A associação entre o desmatamento intenso e as elevadas taxas de incidência da hanseníase, também merece atenção16.
Salienta-se que o município de Redenção-PA apresentou maior número de casos. O que pode ser justificado sobretudo pela centralização dos serviços de saúde na cidade, que é o único município com serviços de alta complexidade e, por isso, é considerada um centro de referência em saúde. Em muitos casos, o município de notificação difere do local de origem da doença, o que pode contribuir para o aumento das notificações para a cidade e intensifica os índices de subnotificação nos demais municípios17.
Além disso, por meio da análise temporal foi possível notar que o número de registros reduziu de forma considerável, de 11,7%, em 2019, para 7,2%, 6,5% e 5,4% em 2020, 2021 e 2022 respectivamente. Há evidências que associam esse panorama com a ocorrência de subnotificações intensificadas no ano de 2020, em que todos os Estados brasileiros apresentaram redução no diagnóstico de hanseníase, correlacionando-se com o advento da pandemia17-18. Dessa forma, houve uma redução significativa de 41,4% na detecção de hanseníase na população geral após a disseminação da COVID-19 em 2020. Entretanto, observou-se, um aumento em 8,1% nos casos de hanseníase multibacilar – que é a forma mais graves –, em todo o Brasil no mesmo ano17.
Diante desse cenário, o conhecimento sobre o perfil epidemiológico e a distribuição espacial dos casos entre os municípios pode gerar indicadores importantes das condições de vida, além de contribuírem para ações de promoção e prevenção da saúde com maior sucesso. Principalmente, ao se considerar que a hanseníase tem impacto global, com incidência elevada no Brasil, que é o segundo país com maior número de casos no mundo19-20. Este estudo destaca por meio das análises inferenciais que as correlações na sua maioria são altas, positivas e estatisticamente significantes para todas as variáveis sociodemográficas.
Portanto, as estratégias para eliminação da hanseníase devem ser holísticas e transcenderem o aparato tecnológico do setor saúde, devem incluir aspectos essenciais ao desenvolvimento humano e ao bem-estar. Bem como para os determinantes sociais, a fim de contribuir para o desenvolvimento de políticas públicas voltadas para a eliminação da hanseníase de forma assertiva e local21.
Outro fato que merece atenção, é que apesar de ser uma região amazônica com a presença constante de povos originários, houve baixo número de notificações entre os indígenas quando comparados aos outros grupos étnicos. Este fato pode refletir a menor prevalência da doença por viverem em comunidades isoladas e pela ocorrência de subdiagnósticos, devido a disparidades no acesso aos cuidados de saúde5.
Nesse contexto, destaca-se que a concepção dessa população sobre o processo saúde-doença é diferente da medicina ocidental, o que acarreta diversas dificuldades nas formas de cuidado e assistência em saúde22. A ausência ou diminuição de novos casos nesses indivíduos, é com frequência resultado da inexistência de um fluxograma assistencial robusto e rastreio ativo, o que impossibilita a notificação fidedigna de doenças infecciosas e parasitárias em populações indígenas5,23.
Além das problemáticas apresentadas, o diagnóstico da hanseníase ainda é um desafio em virtude dos entraves associados ao diagnóstico clínico e à impossibilidade de cultivo do bacilo in vitro. O diagnóstico na prática clínica ainda é baseado na observação dos sinais e sintomas, sustentado em exames como a baciloscopia por esfregaço de pele ou biópsia24-25.
Esse diagnóstico pode ser retardado na vigência de profissionais não treinados em reconhecer os primeiros sinais da doença, principalmente em países desenvolvidos, nos quais a hanseníase está quase erradicada ou é extremamente rara24-25. O presente estudo destaca que se observou baixa adesão à realização da baciloscopia na região de saúde do Araguaia.
Nesse prisma, diagnósticos e condutas terapêuticas aprimoradas e assertivas para a hanseníase ainda são um desafio significativo25. Isso foi corroborado na atual pesquisa ao se observar a frequência de erros associados ao diagnóstico, que representou 1%. Este é um dano que impede o tratamento precoce, contribui com a manutenção da cadeia de transmissão e favorece a ocorrência de sequelas e incapacidades26.
Isso foi evidenciado, também, em estudo realizado no Estado do Mato Grosso, porque 354 indivíduos com hanseníase foram liberados do tratamento por erro de diagnóstico; destes, 162 foram entrevistados. Dentre eles, 35,8% tinham como diagnóstico final uma doença musculoesquelética ou do tecido conjuntivo, seguidos por 13,6% com diagnósticos de doenças de pele e tecido subcutâneo. Para 23,5% dos entrevistados, nenhum diagnóstico alternativo foi estabelecido; enquanto 7,4% foram, posteriormente, rediagnosticados com hanseníase26.
Com isso, percebe-se que é crucial a preparação de todos os profissionais com treinamento adaptado as suas necessidades e habilidades, como também integre os programas de saúde e os aspectos de liderança e gestão. Assim, é possível manter o nível de conscientização, aprimorar as habilidades diagnósticas e mitigar o preconceito da equipe em relação à patologia27.
Em relação ao tratamento, observou-se neste estudo que na região de saúde do Araguaia o esquema terapêutico mais utilizado foi o PQT-MB de doze doses (78%) e o principal desfecho foi a cura dos pacientes (69,5%). Para reforçar este dado, estudo de coorte, evidenciou dez casos de recidiva em uma coorte de 713 pacientes acompanhados por uma média de 12,1 anos. Além disso, foi descrito risco muito baixo observado para pacientes multibacilares (MB) tratados com doze doses, reforçando o sucesso do esquema atual28-29.
Outra proposição é que os pacientes paucibacilares (PB) possuem menor adesão ao tratamento que os multibacilares, o que indica que a forma MB apresenta maior motivação para cura30. Apesar da maioria dos pacientes progredirem para a cura ao realizar a terapia de forma adequada, ainda existem casos que evoluem para óbito, sobretudo devido abandono do tratamento. Um estudo realizado em Manila nas Filipinas corrobora com esse fato, no qual, 40% dos participantes abandonaram o tratamento e menos de 60% completaram-no31.
É importante, então, listar os principais fatores associados às taxas de abandono, como a longa duração do regime de terapia múltipla; o estigma associado à doença; os efeitos adversos da multidrogaterapia (MDT); a má relação entre profissional de saúde e o paciente; bem como a ocorrência das reações hansênicas12. Desse modo, é primordial demonstrar as complicações inerentes à falha terapêutica, como o reinício da transmissão e o reaparecimento dos sintomas, geralmente de forma mais agressiva – o que pode evoluir ao óbito32-33. Um estudo demonstrou que o número de óbitos foi diretamente proporcional ao número de pacientes que abandonaram o tratamento32.
Com a finalidade de mitigar essa problemática, ressalta-se que é imprescindível a elaboração de medidas que busquem aumentar a adesão. A participação dos indivíduos diagnosticados com hanseníase em programas sociais como o Bolsa Família (PBF), mostrou-se promissora. Como fora evidenciado em um estudo, no qual a participação no PBF foi associada a uma melhora de 22% na adesão ao tratamento. Além disso, notou-se que taxa de cura foi 43% maior em pessoas com doença multibacilar beneficiárias do programa34.
Nesse contexto, ressalta-se que para mitigar e controlar os casos de hanseníase é crucial considerar os princípios de saúde única (One health), uma abordagem que busca alcançar bons resultados de saúde, uma vez que reconhece a conexão entre pessoas, animais, plantas e o ambiente35. E em face a esses conhecimentos, é possível mapear a magnitude e dinâmica da hanseníase, porque identifica regiões prioritárias de alta endemicidade e intensifica as ações para mitigar ou controlar os casos. Com isso, pode-se destacar a importância do georreferenciamento na detecção de áreas endêmicas e controle das doenças infecciosas36-37.
Por fim, por se tratar de um estudo ecológico este estudo possui algumas limitações, como o fato de utilizar dados secundários e, por isso, não há controle sobre eles. Vale ressaltar que, para evitar falácia ecológica, os dados foram analisados minuciosamente em nível de grupo, não generalizados para o nível individual. Portanto, sugere-se que estudos futuros, ampliem a visão acerca da problemática com estudos de campo, pois aumentará a chance de evidenciar novos achados científicos com o intuito de favorecer novas contribuições para o ensejo dos prejuízos.
5 CONCLUSÃO
Em virtude dos dados e evidências explicitados, é possível inferir que o perfil epidemiológico geral foi composto por indivíduos com ensino fundamental incompleto, do sexo masculino, com idade entre 20-59 anos e pardos, já o menores índices foram descritos para a população indígena. Em relação ao perfil clínico, evidenciou-se que a forma mais frequente foi a dimorfa e quanto a classificação foi a multibacilar. Com relação à distribuição espacial da hanseníase na região do Araguaia, o município de Redenção-PA deteve o maior número de casos. Outros fatos relevantes foram a detecção de erros associados ao diagnóstico e a baixa adesão à baciloscopia. Além disso, o tratamento mais utilizado foi a PQT-MB de 12 doses e a maioria dos casos evoluiu para cura. As análises temporais evidenciaram que durante a pandemia houve decréscimo no número de notificações na região.
Diante disso, há necessidade de ampliação das medidas de vigilância e controle da hanseníase, bem como a autonomia de todos os municípios, principalmente no que diz respeito ao diagnóstico, rastreio e notificação de casos. Além disso, é necessário maior investimento na formação e capacitação da equipe de saúde para que os erros sejam mitigados e ocorra a atenuação das subnotificações e a maior adesão ao tratamento. Com o objetivo de, assim, considerar os conceitos de Saúde Única, sugere-se também a realização de novas pesquisas acerca da correlação da hanseníase com alterações ambientais e variáveis socioeconômicas.
REFERÊNCIAS
- Chen KH, Lin CY, Su SB, Chen KT. Leprosy: A Review of Epidemiology, Clinical Diagnosis, and Management. J Trop Med. 2022;8652062:1-13. doi: 10.1155/2022/8652062.
- Bernardes MP, Oliveira GS, Grattapaglia RPA, Melo JO, França CW, Pereira GM. Análise do Perfil Epidemiológico de Hanseníase no Brasil no período de 2010 a 2019. Braz J Health Rev. 2021;4(6):23692-99.
- Tavares AMR. Epidemiological profile of leprosy in the state of Mato Grosso: descriptive study. Einstein. 2021;19:1-5.
- Lopes FC, Ramos ACV, Pascoal LM, Santos FS, Rolim ILTP, Serra MAAO, et al. Leprosy in the context of the family health strategy in an endemic scenario in Maranhão: Prevalence and associated factors. Cien Saude Colet. 2021;26(5):1805-16.
- Brasil. Ministério da Saúde. Secretaria de Vigilância em Saúde. Hanseníase. Boletim epidemiolóigco. Brasília: Ministério da Saúde; 2022.
- Nery JS, Ramond A, Pescarini JM, Alves A, Strina A, Ichihara MY, et al. Socioeconomic determinants of leprosy new case detection in the 100 Million Brazilian Cohort: a population-based linkage study. Lancet Glob Health. 2019;7(9):e1226-36.
- Ghai RR, Wallace RM, Kile JC, Shoemaker TR, Vieira AR, Negron ME, et al. A generalizable one health framework for the control of zoonotic diseases. Sci Rep. 2022;12(1):1-11.
- Okello AL, Bardosh K, Smith J, Welburn SC. One Health: Past Successes and Future Challenges in Three African Contexts. PLoS Negl Trop Dis. 2014;8(5):e0002624.
- INPE. Coordenação-Geral de Observação da Terra. PRODES – Amazônia [internet]. São José dos Campos: INPE; 2022 [atualizado em 2022 Nov 30; citado em 2023 Maio 20]. Disponível em: http://www.obt.inpe.br/OBT/assuntos/programas/amazonia/prodes#wrapper.
- Pescarini JM, Strina A, Nery JS, Skalinski LM, Andrade KVF, Penna MLF, et al. Socioeconomic risk markers of leprosy in high-burden countries: A systematic review and meta-analysis. PLoS Negl Trop Dis. 2018;12(7):e0006622.
- Rocha ACAA, Junger WL, Cruz WJA, Ignotti E. The impact of seasonal climate on new case detection rate of leprosy in Brazil (2008-2012). Lepr Rev. 2017;88(4):533-42.
- Castro MC, Baeza A, Codeço CT, Cucunubá ZM, Dal’Asta AP, De Leo GA, et al. Development, environmental degradation, and disease spread in the Brazilian Amazon. PLoS Biol. 2019;17(11):e3000526.
- Ellwanger JH, Kulmann-Leal B, Kaminski VL, Valverde-Villegas JM, Veiga ABGD, Spilki FR, et al. Beyond diversity loss and climate change: Impacts of Amazon deforestation on infectious diseases and public health. An Acad Bras Cienc. 2020;92(1):e20181262.
- Depsid P, Rosa PS. One health and Hansen’s disease in Brazil. PLoS Negl Trop Dis. 2021;15(5):e0009433.
- Silva MB, Portela JM, Li W, Jackson M, Gonzalez-Juarrero M, Hidalgo AS, et al. Evidence of zoonotic leprosy in Pará, Brazilian Amazon, and risks associated with human contact or consumption of armadillos. PLoS Negl Trop Dis. 2018;12(6):e0006532.
- Freitas LRS, Duarte EC, Garcia LP. Análise da situação epidemiológica da hanseníase em uma área endêmica no Brasil: Distribuição espacial dos períodos 2001-2003 e 2010-2012. Rev Bras Epidemiol. 2017;20(4):702-13.
- Paz WS, Souza MDR, Tavares DDS, Jesus AR, Santos AD, Carmo RF, et al. Impact of the COVID-19 pandemic on the diagnosis of leprosy in Brazil: An ecological and population-based study. Lancet Reg Health – Am. 2022;9:100181-91.
- Pernambuco ML, Ruela GA, Santos IN, Bomfim RF, Hikichi SE, Lira JLM, et al. Hanseníase no Brasil: ainda mais negligenciada em tempos de pandemia do COVID–19?. Rev Saúde Pública Paraná. 2022;5(1):2-18.
- Alves JM, Rodrigues RP, Carvalho MCS. Perfil epidemiológico e espacial dos casos novos de hanseníase notificados em Feira de Santana no período de 2005-2015. Rev Pesqui Fisioter. 2021;11(2):334-41.
- Traúzola TR, Ribeiro AE, Martins AS, Meneguci CAG, Ahmad ITK, Lima GH, et al. Panorama geral da hanseníase no Brasil: uma análise epidemiológica. Rev Eletr Acervo Saude. 2022;15(6):1-10.
- Assis IS, Arcoverde MAM, Ramos ACV, Alves LS, Berra TZ, Arroyo LH, et al. Social determinants, their relationship with leprosy risk and temporal trends in a tri-border region in Latin America. PLoS Negl Trop Dis. 2018;12(4):e0006340.
- Bautista-Valarezo E, Duque V, Verdugo Sánchez AE, Dávalos-Batallas V, Michels NRM, Hendrickx K, et al. Towards an indigenous definition of health: an explorative study to understand the indigenous Ecuadorian people’s health and illness concepts. Int J Equity Health. 2020;19(1):101-9.
- Badanta B, Lucchetti G, Barrientos-Trigo S, Fernández-García E, Tarriño-Concejero L, Vega-Escaño J, et al. Healthcare and health problems from the perspective of indigenous population of the Peruvian Amazon: a qualitative study. Int J Environ Res Public Health. 2020;17(21):7728-46.
- Pallares CD, Bourassa-Blanchette S, Fonseca K, Vaughan S. Leprosy: Challenges in diagnosis. J Assoc Med Microbiol Infect Dis Can. 2019;4(3):187-89.
- Chen KH, Lin CY, Su SB, Chen KT. Leprosy: A review of epidemiology, clinical diagnosis, and management. J Trop Med. 2022;2022:8652062.
- Neves KVRN, Machado LMG, Lisboa MN, Steinmann P, Ignotti E. Self-reported clinical history of misdiagnosed leprosy cases in the State of Mato Grosso, Brazil, 2016-2019. Cad Saúde Pública. 2023;39(5):e00279421.
- Dharmawan Y, Fuady A, Korfage IJ, Richardus JH. Delayed detection of leprosy cases: A systematic review of healthcare-related factors. PLoS Negl Trop Dis. 2022;16(9):e0009972.
- Nery JAC, Sales AM, Hacker MAVB, Moraes MO, Maia RC, Sarno EN, et al. Low rate of relapse after twelve-dose multidrug therapy for Hansen’s disease: A 20-year cohort study in a Brazilian reference center. PLoS Negl Trop Dis. 2021;15(5):e0009382.
- Pires CAA, Santos MAL, Biasi BH, Moreira AG, Coimbra AC, Ferreira MC, et al. Análise da ocorrência de reações adversas à poliquimioterapia no tratamento para hanseníase. Rev Eletr Acervo Saude. 2021;13(2):e6233.
- Susanti IA, Mahardita NGP, Alfianto R, Sujana IMIWC, Siswoyo, Susanto T. Social stigma, adherence to medication and motivation for healing: A cross-sectional study of leprosy patients at Jember Public Health Center, Indonesia. J Taibah Univ Med Sci. 2017;13(1):97-102.
- Pepito VCF, Amit AML, Samontina RED, Abdon SJA, Fuentes DNL, Saniel OP. Patterns and determinants of treatment completion and default among newly diagnosed multibacillary leprosy patients: A retrospective cohort study. Heliyon. 2021;7(6):e07279.
- Peixoto MF, Campos ACV. Associação entre óbitos por hanseníase e abandono de tratamento no Brasil – 2005 a 2015. III Seminário de Iniciação Científica da UNIFESSPA; 14 e 15 set 2017; UNIFESSPA. Marabá: PROPIT/UNIFESSPA; 2017.
- Gomes MDMB, Oliveira CP, Anversa MB, Resende NBC, Dias SH. Hanseníase: Perfil Epidemiológico E Possíveis Causas De Abandono Do Tratamento. Braz J Dev. 2020;6(9):73667-83.
- Pescarini JM, Williamson E, Nery JS, Ramond A, Ichihara MY, Fiaccone RL, et al. Effect of a conditional cash transfer programme on leprosy treatment adherence and cure in patients from the nationwide 100 Million Brazilian Cohort: A quasi-experimental study. Lancet Infect Dis. 2020;20(5):618-27.
- Mackenzie JS, Jeggo M. The one health approach – why is it so important? Trop Med Infect Dis. 2019;4(2):88-91.
- Silva CLM, Fonseca SC, Kawa H, Palmer DOQ. Spatial distribution of leprosy in Brazil: A literature review. Rev Soc Bras Med Trop. 2017;50(4):439-49.
- Bueno IC, Lages DDS, Lana FCF. Spatial analysis of the epidemiological risk of leprosy in the municipalities of Minas Gerais. PLoS Negl Trop Dis. 2023;17(6):e0011381.
* Mestre em Ciências Ambientais e Saúde (Pontifícia Universidade Católica de Goiás); Doutoranda em Infectologia (Universidade Federal de São Paulo). Faculdade de Ensino Superior da Amazônia Reunida, Avenida Brasil, nº 1435, Alto Paraná, Redenção-PA.
† Doutorado em Zootecnia – Produção Animal (Universidade Estadual Paulista Júlio de Mesquita Filho); Universidade Estadual Paulista Júlio de Mesquita Filho, Rua Quirino de Andrade, nº 215, Centro, São Paulo-SP.
‡ Graduanda do curso de Medicina, Faculdade de Ensino Superior da Amazônia Reunida, Avenida Brasil, nº 1435, Alto Paraná, Redenção-PA.
§ Graduanda do curso de Medicina, Faculdade de Ensino Superior da Amazônia Reunida, Avenida Brasil, nº 1435, Alto Paraná, Redenção-PA.