Artigo de revisão
PERFIL EPIDEMIOLÓGICO DE PACIENTES COM MELANOMA CUTÂNEO EM UMA CIDADE DO SUL DE SANTA CATARINA
Epidemiological profile of patients with cutaneous melanoma in a city in southern Santa Catarina
https://doi.org/10.18593/evid.30161
Recebido em 25 de abril de 2022 | aceito em 18 de maio de 2022
Beatriz de Oliveira Kock* Kelser de Souza Kock†
Kelser de Souza Kock†
Resumo:
O melanoma maligno cutâneo (MMC) é uma neoplasia da pele cuja incidência tem aumentado nas últimas décadas, e Santa Catarina é o estado com maior incidência em todo o país. Objetivo: Avaliar a localização, tamanho e profundidade das lesões por MMC em um laboratório de referência de patologia no sul de Santa Catarina no período entre 2007 e 2017. Metodologia: Foi realizado um estudo transversal documental retrospectivo, composto pelos laudos anatomopatológicos de pacientes cujas biópsias de pele foram encaminhadas ao laboratório estudado no período entre 2007 e 2017. Foram incluídos pacientes cujo laudo confirmou o diagnóstico de melanoma maligno cutâneo no período entre 2007 e 2017. Resultados: Foram analisados 232 casos de MMC. A maior prevalência ocorreu na faixa etária entre 50 e 69 anos. Foi constatado um aumento linear no número de ocorrências no período estudado. Foi encontrada associação estatisticamente significativa entre o índice de Breslow, a presença de ulceração e o número de mitoses tumorais (p<0,001). Conclusão: Os dados encontrados apresentaram associação significativa entre o índice de Breslow, a presença de ulceração e o número de mitoses tumorais.
Palavras-chave: Melanoma. Neoplasias Cutâneas. Estadiamento de Neoplasias. Epidemiologia.
Abstract:
Cutaneous malignant melanoma (CMM) is a skin neoplasm with increasing incidence in the recent decades, and Santa Catarina is the state with the highest incidence in the entire country. Objective: To evaluate the location, size and depth of CMM lesions in a pathology reference laboratory in southern Santa Catarina between 2007 and 2017. Methodology: A retrospective cross-sectional documentary study was carried out, consisting of the anatomopathological reports of patients whose skin biopsies were sent to the laboratory studied in the period between 2007 and 2017. Patients whose report confirmed the diagnosis of cutaneous malignant melanoma in the period between 2007 and 2017 were included. Results: We analyzed 232 cases of CCM. The highest prevalence occurred in the 50 to 69 age group. There was a linear increase in the number of occurrences in the period studied. A statistically significant association was found between the Breslow index, the presence of ulceration and the number of tumor mitoses (p<0.001). Conclusion: The data found showed a significant association between the Breslow index, the presence of ulceration and the number of tumor mitoses.
Keywords: Melanoma. Skin Neoplasms. Staging of Neoplasms. Epidemiology.
@Autor correspondente: Doutor em Ciências Médicas. Professor do Curso de Medicina da Universidade do Sul de Santa Catarina, Tubarão/SC; Av. Jose Acácio Moreira, 787, Bairro Dehon – CEP 88704-900 – Tubarão/SC; https://orcid.org/0000-0002-0117-6142; kelserkock@yahoo. com.br.
1 INTRODUÇÃO
O melanoma maligno cutâneo (MMC) é definido como um tumor maligno com origem nos melanócitos, e, apesar de poder se desenvolver a partir de nevos preexistentes, mais de 50% dos casos são de novo, ou seja, surgem sem a existência de qualquer lesão prévia1. É a neoplasia maligna de pele menos incidente, responsável por cerca de apenas 4-5% dos casos2. Contudo, apresenta pior prognóstico e maior letalidade, causando, isoladamente, cerca de 80% do total de mortes por malignidades cutâneas3-5.
Como outras neoplasias malignas, o MMC é multifatorial em sua etiologia, sendo determinado por interações genéticas, ambientais e comportamentais. Essa patologia tem a maior prevalência em indivíduos caucasianos, e tem sua maior incidência entre os 40 a 60 anos3. Dentre os fatores de risco mais conhecidos, há a exposição à radiação ultravioleta (RUV) e história prévia de queimaduras solares, principalmente em indivíduos de fototipos I e II, e o fator genético, que também tem um importante papel em seu desenvolvimento6,7.
Nas últimas décadas, a incidência do MMC vem aumentando tanto no Brasil como no resto do mundo8 e, segundo dados do Instituto Nacional do Câncer – INCA, estima-se a ocorrência de 8.450 novos casos no Brasil em 2020, sendo 4.200 em homens e 4.250 em mulheres9. Neste mesmo ano, Santa Catarina, com uma população de descendência predominantemente europeia e de pele clara, teve a maior estimativa de incidência em todo o país, com 12,13 casos a cada 100 mil homens e 11,54 casos a cada 100 mil mulheres9,10.
Nesta perspectiva, o presente estudo teve como objetivo avaliar dados epidemiológicos das lesões encontradas em pacientes diagnosticados com MMC em um laboratório de patologia de referência de uma cidade do sul de Santa Catarina, analisando a localização, tamanho e profundidade das lesões encontradas. É esperado que um melhor entendimento do perfil epidemiológico destas lesões possa vir a auxiliar na detecção precoce de futuros casos e, dessa forma, melhorar seus prognósticos.
2 MÉTODOS
2.1 DESENHO
Foi realizado um estudo transversal documental de caráter retrospectivo. O estudo foi composto pelos laudos anatomopatológicos de pacientes cujas biópsias de pele com suspeição de melanoma maligno cutâneo foram encaminhadas para um Laboratório da cidade de Tubarão – SC, no período entre 2007 e 2017.
2.2 PARTICIPANTES
Para a seleção da amostra do presente estudo foram incluídos pacientes maiores de 18 anos, cujo laudo anatomopatológico confirmou o diagnóstico de MMC no período entre 2007 e 2017. Foram excluídos do estudo os pacientes cujos laudos anatomopatológicos apresentavam-se incompletos ou com informações relevantes faltantes.
2.3 VARIÁVEIS
As variáveis pesquisadas foram: sexo (masculino ou feminino), idade (em anos), data do diagnóstico (em dia, mês e ano), topografia (local do corpo), índice de Breslow (em milímetros), nível de Clark (categorizações I, II, III, IV ou V), ulceração (positiva ou negativa), número de mitoses por campo (<5 ou >5 por campo), invasão angiolinfática (positiva ou negativa), ampliação de margem (sim ou não), resultado da ampliação de margemcaso tenha sido feita (positiva ou negativa), pesquisa de linfonodo sentinela (sim ou não), número de linfonodos sentinelas caso a pesquisa de linfonodos sentinelas tenha sido feita (em número inteiro), resultado da pesquisa de linfonodos sentinelas caso tenha sido feita (positivo ou negativo), realização de linfadenectomia (sim ou não), número de linfonodos ressecados na linfadenectomia caso tenha sido feita (em número inteiro), e por último, a classificação dos linfonodos retirados em linfadenectomia caso tenha sido feita (comprometido ou negativo).
2.4 ASPECTOS ÉTICOS
O estudo foi submetido ao Comitê de Ética em Pesquisa da Unisul (CEP − Unisul) e após a sua aprovação (parecer nº 4.594.372) foi iniciada a coleta de dados.
2.5 ANÁLISE DE DADOS
Os dados foram apresentados por meio de números absolutos e percentuais (frequência absoluta e relativa), medidas de tendência central e de dispersão. As variáveis foram comparadas por meio dos testes qui-quadrado e regressão linear. Foi considerado intervalo de confiança de 95%, com nível de significância estatística de 5%.
3 RESULTADOS
No presente estudo foi feita a análise de 232 laudos com diagnóstico de MMC. Os pacientes foram agrupados em faixas etárias, por décadas, com início a partir da segunda década de vida (10-19 anos) devido à ausência de ocorrências antes da mesma. A média de idade foi de 58,1 anos, com desvio-padrão de ± 14,8 anos, sendo a menor 18 anos e a maior, 90 anos. A maior prevalência se deu entre a quinta e a sexta décadas de vida, de acordo com o exposto na Tabela 1. Dentre a amostra, 122 (52,6%) das pacientes eram do sexo feminino.
As topografias das lesões foram divididas em quatro segmentos anatômicos, à exceção dos 25 (10,8%) laudos que não possuíam tal informação. Nos 207 (89,2%) laudos com esta variável disponível, observou-se que a maioria das lesões estava localizada em região de tronco, totalizando 85 (36,6%) em número, seguida por 54 (23,3%) em região de cabeça e pescoço, conforme mostrado na Tabela 1. As regiões perianal, de colo uterino, conjuntiva e cavidade oral tiveram, cada uma, apenas 1 (0,42%) ocorrência, sendo então descritas como a categoria “outras” (1,7%).
Tabela 1 – Características demográficas dos pacientes e topografia das lesões.
|
N |
(%) |
|
|
Sexo |
||
|
Feminino |
122 |
52,6 |
|
Masculino |
110 |
47,4 |
|
Faixa etária (anos) |
||
|
10-19 |
1 |
0,4 |
|
20-29 |
6 |
2,6 |
|
30-39 |
19 |
8,2 |
|
40-49 |
50 |
21,6 |
|
50-59 |
43 |
18,6 |
|
60-69 |
57 |
24,7 |
|
70-79 |
37 |
16,0 |
|
80-90 |
18 |
7,8 |
|
N/I |
1 |
0,4 |
|
Topografia |
||
|
Cabeça/pescoço |
54 |
23,3 |
|
MMII |
33 |
14,2 |
|
MMSS |
31 |
13,4 |
|
Outras |
4 |
1,7 |
|
Tronco |
85 |
36,6 |
|
N/I |
25 |
10,8 |
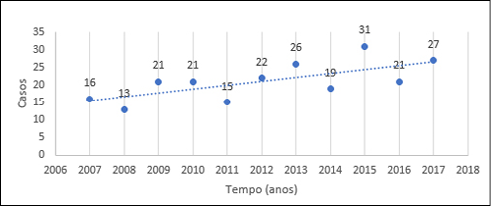
As datas de diagnóstico foram estratificadas anualmente, variando entre 2007 e 2017, conforme mostrado na Figura 1. Foi observada uma forte correlação positiva significativa (r=0,693; p=0,018) com coeficiente β=1,127 (IC 95% 0,243 – 2,011) casos/ano.

Figura 1 – Diagnósticos de melanoma maligno cutâneo entre 2007 e 2017.
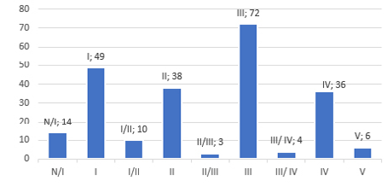
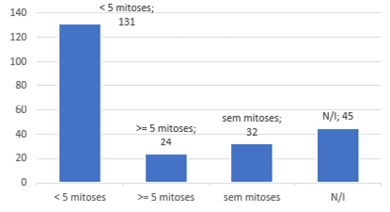
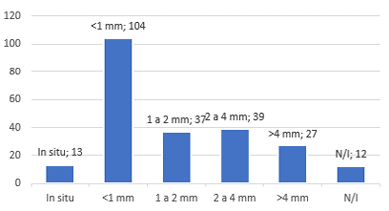
Os índices de Breslow foram categorizados em in situ, <1 mm, entre 1 e 2 mm, entre 2 e 4 mm e >4 mm. Os níveis de Clark nos laudos foram descritos variando entre I, I/II, II, II/III, III, III/IV, IV e V. Os dados apanhados para esses parâmetros estão ilustrados na Figura 2, juntamente com o número de mitoses das lesões.
|
Índice de Breslow |
|
|
Nível de Clark |
|
|
Número de mitoses |
|
Figura 2 – Estratificação dos índices de Breslow, níveis de Clark e número de mitoses das lesões.
Apenas 62 (26,7%) dos pacientes apresentaram lesão ulcerada nos laudos analisados, enquanto 170 (73,3%) não apresentaram ulceração. Dos laudos, 20 (8,6%) apresentaram positividade para invasão angiolinfática. Os demais 212 (91,4%) não expressaram esta informação. A ampliação de margem foi feita em 102 (43,8%) casos, com 93 (39,9%) apresentando negatividade, oito (3,4%) apresentando positividade, e uma (0,4%) com esta informação faltante. Os outros 131 (56,2%) casos não faziam menção a esta informação.
Os linfonodos sentinelas foram pesquisados em 29 (12,4%) casos, com oito (3,4%) dos resultados positivos e 20 (8,6%) dos resultados negativos; apenas um (0,4%) caso não apontava positividade ou negatividade. Os 204 (87,6%) casos restantes não citaram esta informação. Foi realizada a linfadenectomia em 23 casos, sendo que em 14 (6,0%) delas houve comprometimento linfonodal, e em 8 (3,4%), não. Apenas 1 (0,4%) caso foi inconclusivo. Os demais 210 (90,1%) dos laudos não indicaram esta informação.
A Tabela 2 mostra as comparações realizadas entre os valores de Breslow e a Topografia, o Linfonodo sentinela, a Ulceração, o número de Mitoses e o Sexo; enquanto a Tabela 3 apresenta as comparações feitas entre a Topografia e o Sexo e a Idade. A Tabela 4 expõe as comparações feitas entre a Ulceração e o Linfonodo Sentinela e as Mitoses.
Tabela 2 – Comparação entre os níveis de Breslow e a Topografia, o Linfonodo sentinela, a Ulceração, o número de Mitoses e o Sexo.
|
In situ n(%) |
< 1mm n(%) |
1-2mm n(%) |
2-4mm n(%) |
> 4mm n(%) |
p |
|
|
Topografia |
||||||
|
Cabeça/pescoço |
4 (7,8) |
28 (54,9) |
7 (13,7) |
7 (13,7) |
5 (9,8) |
0,382 |
|
MMII |
2 (6,1) |
10 (30,3) |
7 (21,2) |
7 (21,2) |
7 (21,2) |
|
|
MMSS |
2 (7,1) |
16 (57,1) |
4 (14,3) |
5 (17,9) |
1 (3,6) |
|
|
Outras |
0 (0,0) |
0 (0,0) |
0 (0,0) |
2 (100,0) |
0 (0,0) |
|
|
Tronco |
4 (4,9) |
10 (12,2) |
17 (20,7) |
13 (15,9) |
10 (12,2) |
|
|
Linfonodo sentinela |
||||||
|
Negativo |
0 (0,0) |
3 (15,0) |
6 (30,0) |
6 (30,0) |
5 (25,0) |
0,368 |
|
Positivo |
0 (0,0) |
1 (14,3) |
0 (0,0) |
4 (57,1) |
2 (28,6) |
|
|
Ulceração |
||||||
|
Negativa |
13 (8,0) |
102 (63,0) |
29 (17,9) |
12 (7,4) |
6 (3,7) |
<0,001 |
|
Positiva |
0 (0,0) |
2 (3,4) |
8 (13,8) |
27 (46,6) |
21 (36,2) |
|
|
Número de Mitoses |
||||||
|
0 por campo |
4 (12,5) |
24 (75,0) |
1 (3,1) |
2 (6,3) |
1 (3,1) |
<0,001 |
|
< 5 por campo |
5 (3,9) |
56 (43,4) |
28 (21,7) |
25 (19,4) |
15 (11,6) |
|
|
> 5 por campo |
0 (0,0) |
0 (0,0) |
5 (21,7) |
9 (39,1) |
9 (39,1) |
|
|
Sexo |
||||||
|
Feminino |
10 (8,5) |
64 (54,2) |
21 (17,8) |
13 (11,0) |
10 (8,5) |
0,005 |
|
Masculino |
3 (2,9) |
40 (39,2) |
16 (15,7) |
26 (25,5) |
17 (16,7) |
Tabela 3 – Comparação entre a Topografia e o Sexo e a Idade.
|
Cabeça/pescoço n(%) |
MMII n(%) |
MMSS n(%) |
Outras n(%) |
Tronco n(%) |
p |
||
|
Sexo |
|||||||
|
Feminino |
15 (12,3) |
23 (18,9) |
21 (17,2) |
18 (14,8) |
3 (2,5) |
42 (34,4) |
0,321 |
|
Masculino |
10 (9,1) |
31 (28,2) |
12 (10,9) |
13 (11,8) |
1 (0,9) |
43 (39,1) |
|
|
Idade |
|||||||
|
10-19 |
0 (0,0) |
0 (0,0) |
0 (0,0) |
1 (100,0) |
0 (0,0) |
0 (0,0) |
0,645 |
|
20-29 |
1 (16,7) |
1 (16,7) |
0 (0,0) |
1 (16,7) |
0 (0,0) |
3 (50,0) |
|
|
30-39 |
1 (5,3) |
2 (10,5) |
4 (21,1) |
3 (15,8) |
0 (0,0) |
9 (47,4) |
|
|
40-49 |
3 (6,0) |
12 (24,0) |
5 (10,0) |
8 (16,0) |
1 (2,0) |
21 (42,0) |
|
|
50-59 |
6 (14,0) |
8 (18,6) |
6 (14,0) |
6 (14,0) |
0 (0,0) |
17 (39,5) |
|
|
60-69 |
5 (8,8) |
15 (26,3) |
8 (14,0) |
9 (15,8) |
0 (0,0) |
20 (35,1) |
|
|
70-79 |
5 (13,5) |
13 (35,1) |
5 (13,5) |
2 (5,4) |
1 (2,7) |
11 (29,7) |
|
|
80-90 |
4 (22,2) |
3 (16,7) |
5 (27,8) |
1 (5,6) |
1 (5,6) |
4 (22,2) |
Tabela 4 – Comparação entre a Ulceração e o Linfonodo sentinela e as Mitoses.
|
Negativa n(%) |
Positiva n(%) |
p |
|
|
Linfonodo sentinela |
|||
|
Negativo |
8 (40,0) |
12 (60,0) |
0,159 |
|
Positivo |
1 (12,5) |
7 (87,5) |
|
|
Número de Mitoses |
|||
|
0 por campo |
30 (93,8) |
2 (6,3) |
<0,001 |
|
< 5 por campo |
94 (71,8) |
37 (28,2) |
|
|
> 5 por campo |
9 (37,5) |
15 (62,5) |
4 DISCUSSÃO
O MMC é uma neoplasia da pele que, por ter origem melanocítica, desenvolve-se mais comumente em áreas corporais com mais exposição à radiação solar, sendo este também o mais extensivamente reconhecido fator de risco para seu aparecimento. Ainda que mais da metade dos casos tenha surgimento sem a existência de lesões prévias, ou seja, de novo, ressalta-se que a fotoexposição em si já configura um tipo de agressão à pele, sendo negligenciada por uma grande parte da população, especialmente em um país como o Brasil, cuja cultura praiana e de bronzeamento durante o verão é amplamente difundida e não é permeada pelo uso de produtos com fator de proteção solar adequado11,12.
Mesmo sendo a exposição à radiação solar o mais importante fator de risco, o MMC é, tal qual outras neoplasias malignas, multifatorial em sua etiologia. Outros agentes conhecidos incluem fatores genéticos e fototipos mais baixos, especialmente os fototipos I e II. Neste quesito, a população catarinense encontra-se particularmente vulnerável, tendo em vista que a maior parte da população é composta por indivíduos caucasianos e de ascendência europeia, o que pode justificar o fato de Santa Catarina ser o estado brasileiro com maior incidência de MMC, o que se torna ainda mais relevante quando contraposto com as estatísticas que mostram o aumento global da incidência do MMC. O presente estudo sustenta essa afirmação, posto que os resultados explicitam um aumento de 1,127 ao ano no número de casos de melanoma cutâneo entre 2007 e 2017. Isso pode se dar tanto em virtude do aumento real do número de casos quanto pelo aumento do número de diagnósticos, levando em consideração a disseminação de campanhas de conscientização acerca do tema e maior acesso à informação por parte da população e dos próprios profissionais de saúde, ou, ainda, uma combinação de ambos6-10.
O número obtido de casos foi coincidente com o número esperado de ocorrências para o município determinado, sendo que a população atual é de aproximadamente 107.143 habitantes, de acordo com as últimas projeções do IBGE e do INCA9,13. Dentre a amostra, a maior prevalência do diagnóstico foi obtida entre os 50 a 69 anos, em 100 (43,3%) dos pacientes, com média de idade de 58,1 anos, aproximando-se dos dados mostrados em estudos de caráter similar, e sendo esta, inclusive, a faixa etária que apresentou maior mortalidade por MMC no estado de Santa Catarina12. Isso reforça o fato de que a exposição solar tem efeito cumulativo e danoso à pele, com raras ocorrências em indivíduos abaixo dos 30 anos. Da mesma maneira, em respeito ao sexo, foi observado que 123 (52,8%) das pacientes eram femininas, novamente ressoando com o já encontrado na literatura. Uma justificativa possível para tal pode ser a maior preocupação das mulheres com a própria saúde e maior procura por atendimento médico, com o consequente aumento tanto da quantidade de diagnósticos quanto da detecção precoce, aspecto que já foi ressaltado em outros estudos de cunho parecido e corroborado pelos dados do presente trabalho, os quais demonstram que a maioria das lesões, e especialmente em mulheres, foram diagnosticadas ainda em estágios iniciais2-5,12-16.
No tocante à topografia, ambos os sexos apresentaram predominância de lesões em tronco, seguido por lesões em cabeça e pescoço, coincidindo com o visto em artigos com proposta semelhante, os quais também demonstram ocorrência das lesões majoritariamente nas regiões de tronco, porém divergindo tanto do presente artigo quanto entre si em relação à segunda topografia mais afetada, alternando entre cabeça e pescoço e membros superiores14-17. Outro estudo, entretanto, sugere maior ocorrência das lesões em cabeça e pescoço e, em seguida, membros inferiores18. A faixa etária dos pacientes, por sua vez, não foi um fator relevante na comparação para a topografia no presente estudo, visto que as ocorrências encontram-se distribuídas de forma eventual e não seguem um padrão.
É consolidado na literatura que o índice de Breslow, ou seja, a espessura tumoral, é um fator prognóstico independente de extrema relevância, uma vez que se correlaciona com a taxa de sobrevida e com os riscos de recidiva local e metástases. Por ser um importante parâmetro para determinação desses elementos, o índice de Breslow torna-se, portanto, a variável mais expressiva tanto para o diagnóstico, o estadiamento e o delineamento do tratamento quanto para a correlação com outros dados. Desta maneira, o presente artigo usou esse parâmetro como base para os demais cruzamentos de dados, buscando estabelecer uma conexão entre os aspectos clínicos e anatomopatológicos das lesões de MMC19-21.
Em um estudo específico acerca do tema, Azzola et al.19 descrevem a importância da análise da taxa de mitoses tumorais (TMT) ao diagnóstico de MMC. Após uma extensa revisão da literatura tocante ao assunto, o artigo sugere que a TMT não apenas apresenta correlação próxima com o índice de Breslow, mas também é de fato um importante fator prognóstico independente, mesmo em pacientes com baixa taxa de mitoses. A pesquisa de Namikawa et al.20 também aponta a TMT como o segundo fator preditivo mais importante para o prognóstico do MMC em sua análise. Os dados do presente estudo convergem com essas afirmações, já que os resultados demonstraram associação significativa (p<0,001) entre o índice de Breslow e a TMT, segundo a Tabela 2. Estes achados podem se dar em virtude de tanto o índice de Breslow quanto a TMT serem duas propriedades de um mesmo parâmetro, ou seja, o crescimento tumoral; porém, enquanto o índice de Breslow evidencia a amplificação da lesão em si, a TMT expressa a taxa de metabolismo tumoral, isto é, a atividade da neoplasia. Apesar do presente estudo não ter acesso aos desfechos dos casos pesquisados, a relação observada entre a TMT e o índice de Breslow e também o próprio conceito da TMT permitem ressaltar sua relevância para o manejo dos casos diagnosticados como MMC, posto que, uma vez constatada a maior taxa de atividade neoplásica, um tratamento mais rápido e efetivo pode ser empregado, aumentando a possibilidade de um desfecho positivo19,20.
A ulceração da lesão de MMC, por sua vez, é definida como ausência de integridade de toda a camada epidérmica em qualquer porção acima do tumor primário, e seu processo de aparecimento ainda não é inteiramente compreendido, porém acredita-se que o rápido crescimento tumoral e a interrupção do suprimento vascular dérmico seriam os principais causadores da necrose epidérmica. A ulceração é o segundo fator mais relevante para o estadiamento tumoral do MMC, precedido apenas pelo índice de Breslow, sendo também um importante elemento preditor de mau prognóstico, dado que está relacionado com menores taxas de sobrevida sem recorrência. Apesar do presente estudo não ter constatado correspondência entre a presença de ulceração e a positividade do linfonodo sentinela, o cruzamento de dados entre a ulceração das lesões e o índice de Breslow demonstrou, por sua vez, uma associação significativa (p<0,001) no presente trabalho, conciliando-se com outros estudos em respeito ao assunto e demonstrando que, de fato, a ulceração das lesões está fortemente associada à maior espessura tumoral e, portanto, um quadro clínico mais preocupante20-23. A presença de ulceração também pôde ser correlacionada a uma maior TMT com comprovada significância estatística (p<0,001), segundo os dados apresentados neste trabalho, como visto na Tabela 4. Isso pode comprovar a hipótese de que o rápido crescimento tumoral ou, como discutido no parágrafo anterior, a atividade da neoplasia, pode também estar conectado ao aparecimento da ulceração nas lesões de MMC.
A espessura tumoral, avaliada pelo índice de Breslow, também está associada à positividade da pesquisa de linfonodo sentinela, juntamente com a invasão angiolinfática, segundo uma pesquisa observacional retrospectiva recente20. De forma análoga, Mays et al.24 isolaram o índice de Breslow, a invasão angiolinfática e a idade como variáveis preditoras de metástase linfonodal para pacientes com MMC entre 1 e 2 mm de espessura; entretanto, ao serem estratificados com base nessas informações, os pacientes não puderam ser objetivamente separados em grupos com e sem necessidade de pesquisa de linfonodo sentinela24. Outro estudo de delineamento similar ao presente também discorre sobre a pesquisa de linfonodos sentinelas. Neste, a biópsia de linfonodo sentinela foi realizada em 62,6% dos casos e, avaliada a positividade destes, a linfadenectomia foi indicada, apontando também que tal manejo tem impacto positivo na sobrevida dos pacientes17. No presente trabalho, não foi encontrada uma associação significativa entre o índice de Breslow e a positividade dos linfonodos sentinelas, sendo que a pesquisa de linfonodo sentinela foi realizada em apenas 12,4% dos casos; ademais, como este trabalho não teve acesso ao seguimento dos casos, não se pôde precisar se esta porcentagem foi, de fato, o número real de pesquisas de linfonodo sentinela realizadas, pois há possibilidade tanto de evasão dos demais pacientes, ou seja, de não terem realizado a continuidade da investigação, como de terem dado continuidade à ela, porém em outro serviço. Ainda que tenha havido a impossibilidade de avaliar o desfecho dos casos e a ausência de significância estatística dos dados levantados, reforça-se a importância da pesquisa de linfonodo sentinela, tanto por seu valor prognóstico, já bem estabelecido, quanto pela ausência de dados suficientes que consigam predizer objetivamente quais pacientes necessitam ou não da pesquisa de linfonodo sentinela baseado nas características clínicas e anatomopatológicas das lesões, estando esta ainda indicada em lesões de MMC acima de 1mm, visto que são o grupo de pacientes que mais se beneficiam de um estadiamento linfonodal adequado24,25.
Apesar do laboratório cujos laudos foram pesquisados ser uma referência no município tanto para a saúde pública quanto para a privada, admite-se que a amostra estudada não engloba casos suficientes para ser representativa da população da localidade. Ademais, para alguns pacientes, percebeu-se que a investigação acerca das lesões que apresentavam se iniciou em outro local e depois procedeu no laboratório em questão, ou então se iniciou no laboratório pesquisado e depois teve sua continuidade em outro serviço; essa quebra da continuidade da investigação acarretou na falta de algumas informações em determinados laudos, como por exemplo, se foram ou não realizadas a ampliação de margem, a pesquisa de linfonodos sentinelas e a linfadenectomia, o que pode em parte ter prejudicado a análise dos dados de cada paciente de uma forma completa. Entretanto, visto que as principais informações relevantes ao proposto para avaliação do perfil epidemiológico das lesões estavam presentes, o pretendido foi, apesar das limitações, tangível.
O entendimento do perfil epidemiológico das lesões encontradas em pacientes com melanoma maligno cutâneo é de significante importância para aumentar a possibilidade de diagnóstico precoce, especialmente levando-se em conta que o prognóstico piora consideravelmente em estágios mais avançados21,25. O diagnóstico precoce do melanoma cutâneo também diminui os custos do tratamento, gerando uma economia considerável tanto para a rede pública de saúde, quanto para a rede privada, além de ser benéfico para o prognóstico do paciente. Em virtude disso, ressalta-se a importância da continuidade da realização de campanhas e da educação aos pacientes acerca do assunto não só em épocas específicas, mas durante todo o ano, bem como a conscientização dos profissionais das redes pública e privada sobre a importância da procura ativa por lesões que possam ser consideradas suspeitas, já que se trata de um rastreamento fácil, rápido e sem custos, tornando não só possível como também muito viável sua implementação nas rotinas de atendimento aos pacientes17,18.
5 CONCLUSÃO
O presente estudo analisou 232 laudos de pacientes diagnosticados com MMC. Foi constatado um aumento linear no número de ocorrências de melanoma durante o período estudado. Observou-se associação estatisticamente significativa entre o índice de Breslow e a taxa de mitoses tumorais, bem como entre o índice de Breslow e a presença de ulceração nas lesões. O índice de Breslow não expressou conexão relevante com a positividade do linfonodo sentinela e nem com a topografia das lesões. A presença de ulceração também não se mostrou associada à positividade do linfonodo sentinela.
Espera-se que os dados obtidos sejam relevantes para aumentar a possibilidade de diagnóstico precoce de futuros casos de melanoma maligno cutâneo e, desta forma, melhorar o prognóstico dos pacientes com essa patologia.
REFERÊNCIAS
- Hall BJ, et al. Sauer‘s Manual of Skin Diseases. 10th rev. ed. Filadélfia, PA: Lippincott Williams & Wilkins; 2010;313-16. ISBN: 13: 978-1-60547-077-1. E-book.
- Battisti R, Weber AL, Sgrott I, Nunes DH, Schweitzer LC. Avaliação do perfil epidemiológico e da mortalidade dos pacientes com diagnóstico de melanoma cutâneo primário no município de Florianópolis. Anais Brasileiros de Dermatologia. 2020;84:335-42.
- Ministério da Saúde. Secretaria de Atenção à Saúde. Portaria nº 357. Aprova as Diretrizes Diagnósticas e Terapêuticas do Melanoma Maligno Cutâneo; 2013.
- Instituto Nacional do Câncer. Tipos de Câncer. Câncer de pele melanoma; 2020.
- Moreno M, Conte B, Menegat E. Diferenças Clínico-Epidemiológicas entre Pacientes Masculinos e Femininos com Diagnóstico de Melanoma Cutâneo no Oeste de Santa Catarina. Revista Brasileira de Cancerologia. 2015;61:15-21.
- Sociedade Brasileira de Dermatologia. Câncer da pele; 2017.
- Moreno M, Ciotta CM, Vedana GC, Miranda MHF. Risk factors for developing cutaneous melanoma in Santa Catarina, Brazil: a case-control observational study. Journal of Dermatology & Cosmetology. 2017;1(1):10-14.
- World Health Organization. Estimated number of new cases in 2018, worldwide, both sexes, all ages; 2018.
- Instituto Nacional do Câncer. Estimativa 2020; 2019.
- Bakos L, et al. European ancestry and cutaneous melanoma in Southern Brazil. Journal of the European Academy of Dermatology and Venereology. 2009;23:304-07.
- Sociedade Brasileira de Dermatologia. Análise de dados das campanhas de prevenção de câncer de pele promovidas pela Sociedade Brasileira de Dermatologia de 1999 a 2005. Anais Brasileiros de Dermatologia. 2006;81:533-39.
- Flores DA, et al. Perfil epidemiológico da mortalidade por melanoma cutâneo no Estado de Santa Catarina entre 2005 e 2017. UFFS – Universidade Federal da Fronteira Sul; 2019.
- Instituto Brasileiro de Geografia e Estatística. Diretoria de Pesquisas, Coordenação de População e Indicadores Sociais; 2020. Cidades e Estados: Tubarão; 2020.
- de Souza VPD, Unfried AAC. Análise dos dados epidemiológicos e histopatológicos dos laudos anatomopatológicos de melanoma cutâneo diagnosticados no município de Criciúma/SC. Criciúma: Faculdade de Medicina, Universidade do Extremo Sul Catarinense; 2015. 17 p.
- Lima AS, Casemiro KP, Stein CE, Rovere RK. Epidemiology of Melanoma in the South of Brazil: study of a city in the Vale doItajaí from 1999 to 2013. Anais Brasileiros de Dermatologia. 2015;90:185-9.
- Brandão FV, Gontijo B, Pereira AFJR, Bittencourt FV. Epidemiological aspects of melanoma at a university hospital dermatology center over a period of 20 years. Anais Brasileiros de Dermatologia. 2013;88:344-353.
- Foiato TF, et al. Analysis of patients diagnosed with primary cutaneous melanoma in the last six years in Hospital Erasto Gaertner: epidemiological profile. Anais Brasileiros de Dermatologia. 2018;93:332-36.
- Steglich RB, Cardoso S, Gaertner MHCN, Coelho KMPA, Cestari TF, Franco SC. Differences in the diagnosis of primary cutaneous melanoma in the public and private healthcare systems in Joinville, Santa Catarina State, Brazil. Anais Brasileiros de Dermatologia. 2018;93:507-512.
- Azzola MF, et al. Tumor mitotic rate is a more powerful prognostic indicator than ulceration in patients with primary cutaneous melanoma. American Cancer Society. 2003;97:1488-498.
- Namikawa K, et al. Clinical impact of ulceration width, lymphovascular invasion, microscopic satellitosis, perineural invasion, and mitotic rate in patients undergoing sentinel lymph node biopsy for cutaneous melanoma: a retrospective observational study at a comprehensive cancer center. Cancer Medicine. 2018;7:583-593.
- Balch CM, Gershenwald JE, Soong SJ, Thompson JF, Atkins MB, Byrd DR, et al. Final version of 2009 AJCC melanoma staging and classification. Journal of Clinical Oncology. 2009;27:6199-206.
- Balch CM, Wilkerson JA, Murad TM, Soong SJ, Ingalls AL, Maddox WA. The prognostic significance of ulceration in cutaneous melanoma. Cancer. 1980;45(12):3012-17.
- Tas F, Erturk K. Primary tumour ulceration in cutaneous melanoma: its role on TNM stages. Japanese Journal of Clinical Oncology. 2021;51(2):192-198.
- Mays MP, et al. Should all patients with melanoma between 1 and 2 mm Breslow thickness undergo sentinel lymph node biopsy? Cancer. 2010;116:1535-1544.
- Castro LGM, Bakos RM, Duprat JP, Bittencourt FV, Di Giacomo THB, Serpa SS, et al. Brazilian Guidelines for diagnosis, treatment and follow-up of primary cutaneous melanoma – Part II. Anais Brasileiros de Dermatologia. 2016;91(1):49-58.