
Artigo original
EFEITO CITOTÓXICO E GENOTÓXICO DE Sedum praealtum A. DC. – CRASSULACEAE
Cytototoxic and genotoxic effect of Sedum praealtum A. DC. – crassulaceae
https://doi.org/10.18593/evid.29984
Recebido em 25 de janeiro de 2022/ Aceito em 01 de abril de 2022
Alexandre Brol* Anelise Gabriela Grotto†
Anelise Gabriela Grotto† Maria Ignez Marchioro Zaions‡ Katiane Paula Bagatini§
Maria Ignez Marchioro Zaions‡ Katiane Paula Bagatini§

Resumo:
As plantas medicinais são amplamente utilizadas no Brasil, entre elas destaca-se Sedum praealtum A. DC. (bálsamo), Crassulaceae, empregada para problemas inflamatórios e gastrointestinais. Porém, para a maioria destas plantas não existem informações científicas, especialmente quanto ao potencial toxicológico. Assim, o objetivo do trabalho foi avaliar o efeito citotóxico e genotóxico da referida espécie, utilizando como organismo-teste a Lactuca sativa L. (alface), Asteraceae. Foram confeccionados extratos aquosos das folhas e do caule do bálsamo nas concentrações de 5%, 10%, 20% e 40% p v-¹ e o controle apenas com água destilada. Foi realizado o teste de germinação com as sementes de alface em caixa Gerbox® com substrato de papel Germitest® umedecidas com cada tratamento, acondicionadas em câmara BOD à temperatura de 25ºC com regime de luz de 12 horas. A avaliação da germinação ocorreu no quarto e no sétimo dia após a semeadura. A coleta das radículas foi realizada diariamente, até o sétimo dia, para a determinação do índice mitótico e a observação de aberrações cromossômicas. Para a confecção das lâminas foi empregada a técnica de esmagamento, com coloração de Giemsa a 2%. As células foram observadas em microscópio óptico, no qual analisou-se 5.000 células para cada tratamento. Através do teste de germinação verificou-se que os extratos aquosos das folhas e do caule de bálsamo não interferem no índice de germinação nem no IVG, demonstrando a ausência de efeito alelopático. Quanto ao índice mitótico não ocorreram alterações com os extratos provenientes das folhas, enquanto que com o extrato proveniente do caule na concentração de 10% ocorreu redução do índice mitótico, diferindo-o também entre os blocos, caule e folhas. Ocorreram pontes anafásicas no extrato proveniente do caule na concentração 20% e perda de cromossomos inteiros no extrato de caule na concentração de 40%. Os extratos das folhas e caules de Sedum praealtum não apresentam efeito alelopático, mas apresentam efeitos antiproliferativos e genotóxico.
Palavras-chave: Plantas medicinais. Efeito alelopático. Aberrações cromossômicas.
Abstract:
Medicinal plants are extensively used in Brazil; among them stands out the Sedum praealtum A. DC. (balsam), Crassulaceae, used for inflammatory and gastrointestinal problems. However, most medicinal plants have not been studied enough, especially regarding their toxicological potential. Thus, this study is aimed at evaluating the cytotoxic and genotoxic of said species, using Lactuca sativa L. (lacttuce), Asteraceaeas, a test organism. Aqueous extracts of the leaves and stem of the balsam were prepared at concentrations of 5%, 10%, 20%, and 40% p v-¹, and the control was carried out with distilled water only. The germination test was performed with lettuce seeds in a Gerbox® box with Germitest® paper substrate moistened with each treatment, placed in a BOD chamber at a temperature of 25ºC with a 12-hour light regime. Germination evaluation occurred on the fourth and seventh day after sowing. The collection of the rootlets was performed daily up to the seventh day to determine the mitotic index and to observe chromosomal aberrations. The crushing technique was used for making the slides, with Giemsa staining at 2%. The cells were observed under an optical microscope, in which 5,000 cells were analyzed for each treatment. The germination test verified that the aqueous extracts of the leaves and stem of the balm do not interfere with the germinative index or in the germination velocity rate, demonstrating the absence of an allelopathic effect. As for the mitotic index, there are no changes with the extracts from the leaves, while with the extract from the stem at a concentration of 10%, the reduction occurred in the mitotic index, also differing between the blocks, stem, and leaves. Anaphasic bridges appeared in the extract from the stem at 20% concentration and loss of whole chromosomes in the stem extract at 40% concentration. The extracts of the leaves and stem of Sedum praealtum do not have an allelopathic effect, but it does show an antiproliferative and genotoxic effect.
Keywords: Medicinal plants. Allelopathic effect. Chromosomal aberrations.
@Autor correspondente: Doutora em Produção Vegetal pela Universidade do Estado de Santa Catarina; Mestre em Botânica pela Universidade Federal do Paraná; https://orcid.org/0000-0003-2543-0413; katiane.bagatini@unoesc.edu.br.
1 INTRODUÇÃO
Entre as plantas mais utilizadas como medicinal destaca-se a espécie Sedum praealtum A. DC. (Crassulaceae), conhecida popularmente como bálsamo. Esta apresenta ação cicatrizante, auxilia no alívio da dor, no tratamento de gastrite e problemas inflamatórios gerais, além de ser utilizada como ornamental.1
O gênero Sedum compreende mundialmente cerca de 350-500 espécies.2 A espécie S. praealtum A. DC. é originária de regiões de clima quente da América Central, apresenta aproximadamente 60 cm de altura, folhas carnosas, planas, lisas, espatuladas, recurvadas e reunidas em verticilos. As inflorescências são terminais, ramificadas, com numerosas flores amarelas, formadas no outono e no inverno. Pode ser observada como planta isolada ou em agrupamentos, tem preferência pela condição de sol pleno, ocorrendo em terra fértil e permeável, bem como solos pedregosos.3
Os membros da família Crassulaceae estão relacionados com a presença de muitos compostos secundários, tais como flavonoides, esteroides, alcaloides, glicosídeos cianogênicos, triterpenoides, cumarinas e taninos.2 Análises fitoquímicas de extratos hidroalcoólicos das folhas, raízes e caule de S. praealtum A. DC. não identificaram flavonoides totais, mas apresentaram compostos fenólicos equivalentes ao ácido gálico.4 A quantidade destes compostos pode ser alterada devida a ação da sazonalidade, temperatura, disponibilidade hídrica, radiação ultravioleta, nutrientes do solo, poluição atmosférica ou o ataque de patógenos.5
Numerosos produtos oriundos dos metabólitos vegetais são ingeridos ou absorvidos através de chás, comprimidos, loções e pomadas.6 Todavia, podem ser responsáveis por causar alergias no epitélio, distúrbios no sistema circulatório, neurológico, respiratório e gastrointestinal, favorecendo o aparecimento de neoplasias.7
Assim, a avaliação da toxicidade é fundamental, podendo ser realizada através de diferentes organismos-teste, entre eles estão às sementes de alface, Lactuca sativa L. (Asteraceae), que fornecem diversas vantagens, principalmente devido ao baixo custo, fácil cultivo e sensibilidade as alterações no ambiente.8 Apresentando sensibilidade principalmente na detecção de clastogenenicidade (quebra de cromossomos) e aneugenicidade, distúrbio na divisão celular devido a uma disfunção no aparato mitótico.9,12
Assim, com este estudo o objetivo foi avaliar o efeito citotóxico e genotóxico de S. praealtum, utilizando como organismo-teste a L. sativa.
2 MATERIAIS E MÉTODOS
O trabalho foi desenvolvido na Universidade do Oeste de Santa Catarina – Unoesc, Campus de Joaçaba, SC, Brasil. A espécie S. praealtum foi reproduzida na casa de vegetação, através de estacas da planta matriz obtidas do Horto de Plantas Medicinais do Município de Luzerna, SC, Brasil. O clima da área classifica-se como mesotérmico úmido (Cf), subtipo subtopical (Cfa), segundo classificação de Köppen-Geiger.13
Os experimentos foram realizados em esquema fatorial 2 × 4 + 1, sendo dois tipos de materiais vegetais (folhas e caules) e cinco concentrações de extratos aquosos (0, 5, 10, 20 e 40% p v-¹). Para o preparo dos extratos, as folhas e caules frescos foram triturados com o uso de liquidificador comercial em sua máxima rotação por 5 minutos. A maceração foi realizada em temperatura ambiente de 25 ºC, utilizando 80 g do material vegetal e 200 mL de água destilada para a concentração de 40% e, assim, sucessivamente para as menores concentrações. O macerado foi, então, filtrado com papel filtro qualitativo, obtendo-se assim uma relação de peso por volume.
O organismo-teste utilizado no ensaio de germinação foi a Lactuca sativa L. (alface) cultivar mimosa, cujas sementes foram adquiridas no comércio local, em pacotes e sem apresentarem tratamentos com defensivos agrícolas. O experimento contou com quatro repetições de 25 sementes cada, no qual utilizaram-se caixas acrílicas do tipo Gerbox® (11,0 × 11,0 × 3,5 cm), com substrato de papel Germitest® umedecido com cada concentração de extrato, na proporção de 2,5 vezes a massa do substrato seco, conforme as Regras para Análises de Sementes (RAS).14 As caixas Gerbox® foram submetidas à tratamento asséptico prévio com etanol 70%, assim como as sementes, que permaneceram embebidas em hipoclorito de sódio (2%) durante 5 minutos e etanol 70% durante 1 minuto. O papel Germitest® teve tratamento precedente de 2 horas em luz ultravioleta. As caixas Gerbox® com as sementes foram acondicionadas em câmara de germinação tipo BOD sob temperatura constante de 25 ºC, com regime de luz de 12 horas. A primeira contagem de germinação levou em consideração o número de sementes com protrusão da radícula aos quatro dias e a porcentagem de germinação total foi o número de sementes geminadas ao final de sete dias. Além disso, foi calculado o Índice de Velocidade de Germinação (IVG), segundo as Regras para Análise de Sementes.14
A coleta das radículas ocorreu diariamente, sempre no mesmo horário, até totalizar sete dias após a semeadura. Posteriormente as radículas foram utilizadas na determinação do índice mitótico, para o qual foi empregada a técnica de esmagamento.15 As radículas foram fixadas em Carnoy (3:1, etanol:ácido acético) por um período de 24 horas à temperatura ambiente e, após, acondicionadas em freezer.
A preparação do material, para posterior análise do índice mitótico, seguiu a ordem: água destilada por 5 minutos; HCl 5N por 10 minutos, água destilada por 5 minutos e CH3COOH, por 5 minutos, à temperatura ambiente. Após esse procedimento, as radículas foram transferidas para lâmina, quando a coifa foi extraída com auxílio de bisturi para a obtenção do meristema apical. Em seguida, adicionada uma gota de Giemsa a 2% por 10 minutos.
As lâminas das células do ápice radicial de alface foram observadas em microscópio óptico a uma magnitude de 400x. Analisou-se 5.000 células para cada um dos tratamentos, observando o número de células em cada fase da mitose e as possíveis alterações cromossômicas, tais como: quebras cromossômicas, pontes anafásicas, perda de cromossomos inteiros ou formação de micronúcleos. Estas análises foram realizadas somente a nível qualitativo.
O índice mitótico foi calculado para cada tratamento, dividindo-se o número de células em mitose (prófase, metáfase, anáfase e telófase) pelo número total de células (interfase e mitose), multiplicando-se o resultado por 100.
A análise estatística foi realizada pelo software BioEstat 5.0 utilizando o teste ANOVA fatorial (a x b) para verificação da interação, sendo os blocos a origem do material (folha ou caule) e os tratamentos o controle e as concentrações (0, 5, 10, 20 e 40%). Como ocorreram diferenças significativas (0,05) foram aplicados os testes de Lilliefors para analisar a normalidade da amostra, ANOVA um critério para a análise de variância e teste de Tukey para a comparação entre os tratamentos. No teste ANOVA um critério foram comparadas as concentrações da mesma origem e as mesmas concentrações de origens diferentes.
3 RESULTADO
3.1 GERMINAÇÃO DE ALFACE
Os resultados dos extratos aquosos de folhas e caule sobre a germinação das sementes de alface não apresentaram diferenças significativas entre o controle e os demais tratamentos (F(tratamentos) = 1,8641; p(tratamentos) = 0,1420; F(blocos) = 0,2621; p(blocos) = 0,6182; F(interação) = 0,1165; p(interação) = 0,9728) (Figura 1). O IVG não apresentou diferenças com relação ao extrato feito de folhas ou caule e entre as concentrações (F(tratamentos) = 2,3985; p(tratamentos)=0,0715; F(blocos) = 0,1608; p(blocos)=0,6935; F(interação) = 0,1996; p(interação)= 0,9348) (Figura 2).
aA
aA
aA
aA
aA

Figura 1 – Percentual de germinação de sementes de Lactuva sativa L. (Asteraceae) submetidas aos extratos aquosos dos caules e folhas de Sedum praealtum A. DC. (Crassulaceae) com desvio padrão – unidade de medida sementes por dia. Letras iguais indicam inexistência de diferenças estatísticas à nível de significância de 5%, letras minúsculas indicam o comportamento dos tratamentos e as maiúsculas dos blocos.

aA
aA
aA
aA
aA
Figura 2 – Índice de Velocidade de Germinação de sementes de Lactuva sativa L. (Asteraceae) submetidas aos extratos aquosos dos caules e folhas de Sedum praealtum A. DC. (Crassulaceae), unidade de medida sementes por dia. Letras iguais indicam inexistência de diferenças estatísticas à nível de significância de 5%, letras minúsculas indicam o comportamento dos tratamentos e as maiúsculas dos blocos.
3.2 ÍNDICE MITÓTICO E ABERRAÇÕES CROMOSSÔMICAS
Quanto ao índice mitótico ocorreram diferenças entre os tratamentos, blocos e na interação entre os diferentes extratos (F(tratamentos) = 4,2284; p(tratamentos) = 0,0080; F(blocos) = 9,7530; p(blocos) = 0,0042; F(interação) = 7,4627; p(interação) = 0,0004). Com relação às raízes expostas ao extrato aquoso do caule, a concentração de 10% reduziu o índice mitótico quando comparado com os demais tratamentos. Entre os demais tratamentos não ocorreu diferença entre os índices. O índice mitótico na concentração de 10% foi diferente, também, entre os blocos, folha e caule (Figura 3).
Quanto a presença de aberrações cromossômicas, pode-se verificar o aparecimento de pontes anafásicas no extrato proveniente do caule na concentração 20%. Assim como, a perda de cromossomos inteiros no extrato de caule na concentração de 40%.
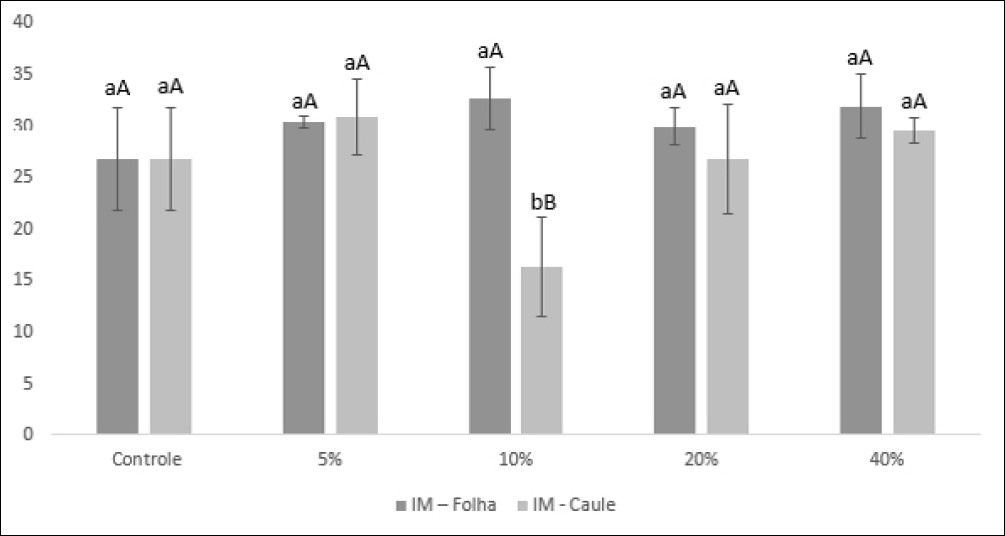
Figura 3 – Índice mitótico (IM) das células das raízes de Lactuva sativa L. (Asteraceae) submetidas aos extratos aquosos das folhas e do caule de Sedum praealtum A. DC. (Crassulaceae): Média e Desvio Padrão. Letras iguais indicam inexistência de diferenças estatísticas à nível de significância de 5%, letras minúsculas indicam o comportamento dos tratamentos e as maiúsculas dos blocos.
4 DISCUSSÃO
4.1 GERMINAÇÃO DE ALFACE
Os resultados obtidos no presente trabalho são similares aos estudos realizados com babosa (Aloe arborescens Mill.), guajuvira (Patagonula americana L.) e falso-boldo (Plecthranthus barbatus Andr.), na concentração de 1/3 (p/v), nos quais os extratos aquosos não afetaram a germinação de sementes de alface.16 O extrato do tipo aquoso pode limitar os efeitos alelopáticos, pois as substâncias apresentam diferentes polaridades,17 como foi demonstrado nas análises fitoquímicas dos extratos de Gochnatia polymorpha (Less) Cabr., conhecida popularmente como Cambará, que apresentou terpenoides nos extratos de éter de petróleo e diclorometano, que são menos polares, e fenóis, terpenoides e saponinas nos extratos etanólicos.18
O mecanismo de ação não ocorre somente sobre a quantidade de sementes germinadas ou sobre a velocidade da germinação, mas podem alterar também o crescimento das plântulas.19 Pesquisadores avaliaram os efeitos alelopáticos dos extratos aquosos do caule e das folhas de Andira humilis Mart. ex Benth, conhecidas como angelim–rasteiro ou angelim-do-campo, e verificaram a alteração no percentual de germinação, no IVG e, principalmente, no crescimento das plântulas de Lactuca sativa L. e Raphanus sativus L.(rabanete), utilizadas como bioindicadores.20
Efeitos alelopáticos prejudiciais somente ocorrem em algumas variedades de plantas, enquanto outras podem apresentar efeito positivos ou neutros.21 Experimentos realizados com o extrato volátil de óleo essencial de jaborandi (Pilocarpus microphyllus Stapf. ex. Wardleworth) demonstraram que este não provoca inibição da germinação de sementes de alface e, inclusive, estimulou o crescimento das radículas, quando comparado com os extratos de Cinnamomum zeylanicum Breyn. (canela), Lippia sidoides Cham. (alecrim-pimenta), Cymbopogum citratus (DC) Stapf. (capim-citronela) e Ocimum gratissimum L. (alfavaca-cravo).22
4.2 ÍNDICE MITÓTICO E ABERRAÇÕES CROMOSSÔMICAS
Resultados semelhantes foram observados por pesquisadores, que identificaram aneugênese ao avaliarem os efeitos do extrato aquoso de Plectrantus barbatus (Andr.), conhecido popularmente como boldo-da-terra, sobre índice mitótico das células meristemáticas de Allium cepa L. (cebola).23 Além disso, cientistas analisaram o extrato aquoso das sementes de mamona (Ricinus communis L.) e do látex de coroa-de-cristo (Euphorbia milii Des Moul.) em diferentes concentrações sobre o sistema A. cepa e apesar de não ter sido verificada a alteração no índice mitótico, os autores, também observaram a presença de anomalias no ciclo mitótico na menor concentração.24
Pesquisadores avaliaram a atividade genotóxica dos extratos hidroalcoólicos das folhas de S. plaealtum (DC.) sob a medula óssea de camundongos. Os resultados não identificaram diferenças (p > 0,05) nas três concentrações (500, 1000 e 2000 mg/ Kg) das amostras em relação ao controle negativo (NaCl), independente o tempo de exposição. Todavia, o extrato apresentou efeitos na divisão e morte celular.4
A presença ou ausência de efeitos toxicológicos dos extratos podem ocorrer pelas diferentes concentrações de compostos secundários nos órgãos vegetais. Essas diferenças foram observadas por outros pesquisadores, que analisaram a concentração de compostos fenólicos totais em diferentes órgãos da espécie medicinal Schinus terebenthifolius (RADDI), popularmente conhecida como aroeira-vermelha.25
Entre os compostos vegetais citoprotetores presentes na espécie S. plaealtum destacam-se os compostos fenólicos. Esses componentes são solúveis em água e possuem atividades antioxidantes.26 Os radicais livres estão envolvidos em processos fisiológicos, todavia, o acúmulo de radicais superperóxidos, radicais hidroxila ou peróxidos de hidrogênios, podem ocasionar danos ao RNA e ao DNA, tais como quebras cromossômicas.27
A atividade citotóxica e genotóxica de espécie S. plaealtum pode ser atribuída a presença de cumarinas, triterpenos, esteroides e alcaloides.28-29 Apesar de algumas dessas substâncias funcionarem como antioxidantes, estudos já demonstraram seus efeitos clastogênicos. Os alcaloides, por exemplo, são utilizados em tratamentos oncológicos por impedirem a polimerização ou despolimerização das proteínas dos microtúbulos e interferirem na replicação do material genético.29-30
5 CONCLUSÃO
Os dados apresentados neste trabalho demonstram que os extratos aquosos de espécie S. praealtum, tanto das folhas quanto do caule, não apresentam efeitos alelopáticos sobre a germinação de sementes de alface. Porém, nas avaliações citotóxicas o extrato do caule na concentração de 10% apresentou atividades antiproliferativas e as ações genotóxicas foram identificadas nos extratos do caule nas concentrações de 20% e 40%. Desta forma, sugere-se cautela na utilização via oral do bálsamo, fazendo-se uso apenas das folhas e pequenas concentrações do caule, necessitando-se de mais estudos para quantificar a concentração da planta que não cause danos moleculares.
REFERÊNCIAS
- Ribeiro DA, Macêdo DG, Oliveira LGS, Saraiva ME, Oliveira SF, Souza MMA, Menezes IRA. Potencial terapêutico e uso de plantas medicinais em uma área de Caatinga no estado do Ceará, nordeste do Brasil. Revista Brasileira de Plantas Medicinais. [Internet]. 2014 [acesso em 2022 Mar 25]; 16(4):912-730. doi: https://doi.org/10.1590/1983-084X/13_059
- Carrasco V. Eficácia do extrato da folha do bálsamo Sedum dendroideum na prevenção e no tratamento da úlcera gástrica induzida em animais [Dissertação]. Dourados: Universidade Federal da Grande Dourados; 2014.
- Lorenzi H, Souza HM. Plantas ornamentais do Brasil: arbustiva, herbáceas e trepadeiras. 3a ed. São Paulo: Nova Odessa; Plantarum; 2001. 476 p.
- Marques MB. Phytochemical screening and evaluation of antimicrobial susceptibility and genotoxicity of Sedum praealtum A. DC. (Balsam) [Dissertação]. Alfenas: Universidade Jose do Rosario Vellano; 2015.
- Gobbo-Neto L, Lopes, NP. Plantas medicinais: fatores de influência no conteúdo de metabólitos secundários. Química nova. [Internet]. 2007 [acesso em 2022 Mar 20]; 30(4): 374-38. doi: https://doi.org/10.1590/S0100-40422007000200026
- Lorenzi H, Matos FJA. Plantas medicinais no Brasil: nativas e exóticas. 2a ed. São Paulo: Plantarum; 2008. 576 p.
- Vasconcelos J, Vieira, JGP, Vieira, EPP. Plantas tóxicas: conhecer para prevenir. Revista Científica da UFPA. 2009;7(1):1-10.
- Komilis DP, Tziouvaras IS. A statistical analysis to assess the maturity and stability of six composts. Waste Management. [Internet]. 2009 [acesso em 2022 Mar 24];29(5):1504-1513. doi: https://doi.org/10.1016/j.wasman.2008.10.016
- Macgregor JT, Heddle JA, Hite M, Margolin BH, Ramel C, Salamone MF, et al. Guidelines for the conduct of micronucleus assays in mammalian bone marrow erythrocytes. Mutation Research/Genetic Toxicology. [Internet]. 1987 [acesso em 2022 Abr 2]; 189(2):103-1012. doi: https://doi.org/10.1016/0165-1218(87)90016-4
- Hayash IM, Tice RR, MacGregor JT, Anderson D, Blakey DH, Kirsh-Volders M, et al. In vivo rodent erytrocyte micronucleus assay. Pesquisa de mutação / mutagênese ambiental e assuntos relacionados. [Internet]. 1994. [acesso em 2022 Abr 2];312(3):293-304. doi: https://doi.org/10.1016/0165-1161(94)90039-6
- Krishna G, Hayashi M. In vivo rodent micronucleus assay: protocol, conduct and data interpretation. Mutation Research/Fundamental and Molecular Mechanisms of Mutagenesis. [Internet]. 2000 [acesso em 2022 Mar 22];455(1-2):155-166. doi: https://doi.org/10.1016/S0027-5107(00)00117-2
- Choy WN. Regulatory genetic toxicology tests. In: Choy WN, organizador. Genetic Toxicolog y and Cancer Risk Assessment. New York: Ed. Marcel Dekker; 2001. p. 93-113.
- Pandolfo C, Braga HJ, Silva Junior VP, Massignam AM, Pereira ES, Thomé VMR, et al. Atlas climatológico digital do Estado de Santa Catarina. Florianópolis: Epagri; 2002.
- Brasil. Ministério da Agricultura, Pecuária e Abastecimento. Secretaria de defesa agropecuária. Regras para análise de sementes. Brasília: Mapa/ACS; 2009. 399 p.
- Guerra MG, Souza MJ. Como observar cromossomos: um guia de técnica em citogenética vegetal, animal e humana. São Paulo: Funpec; 2002. 131 p.
- Mairesse LAS, Costa EC, Farias JR, Fiorin RA. Bioatividade de extratos vegetais sobre alface (Lactuca sativa L.). Revista da FZVA. 2007;14(2).
- Souza Filho APS, Guilhon GMSP, Santos LS. Metodologias empregadas em estudos de avaliação da atividade alelopática em condições de laboratório: revisão crítica. Planta Daninha. [Internet]. 2010 [acesso em 2022 Mar 15];28(3):689-697. doi: https://doi.org/10.1590/S0100-83582010000300026
- Stefanello MEA, Salvador MJ, Ito IY, Macari PAT. Avaliação da atividade antimicrobiana e citotóxica de extratos de Gochnatia polymorpha ssp. floccosa. Revista brasileira farmacognosia. [Internet]. 2006 [acesso em 2022 Mar 15];16(4):525-530. doi: https://doi.org/10.1590/S0102-695X2006000400015
- Ferreira AG, Aquila MEA. Alelopatia: uma área emergente da ecofisiologia. Revista Brasileira de Fisiologia Vegetal. 2000;12(1):175-204.
- Periotto F, Perez SCJGA, Lima MIS. Allelopathic effect of Andira humilis Mart. ex Benth in the germination and growth of Lactuca sativa L. and Raphanus sativus L. Acta Botânica Brasílica. [Internet]. 2004 [acesso em 2022 Mar 18];18(3):425-430. doi: https://doi.org/10.1590/S0102-33062004000300003
- Souza SAM, Cattelan LV, Vargas DP, Brum Piana CF, Bobrowski VL, Rocha BHG. Atividade alelopática e citotóxica do extrato aquoso de espinheira-santa (Maytenus ilicifolia Mart. ex Reiss.). Publicatio UEPG: Ciências Biológicas e da Saúde. [Internet]. 2005 [acesso em 2022 Mar 18];11(3-4):7-14. doi: https://doi.org/10.5212/publicatio%20uepg.v11i3.415
- Alves MDCS, Medeiros Filho S, Innecco R, Torres SB. Alelopatia de extratos voláteis na germinação de sementes e no comprimento da raiz de alface. Pesquisa Agropecuária Brasileira. [Internet]. 2004 [acesso em 2022 Mar 14];39(11):1083-1086. doi: https://doi.org/10.1590/S0100-204X2004001100005
- Iganci JRV, Bobrowski VL, Heiden G, Stein VC, Rocha BHG. Efeito do extrato aquoso de diferentes espécies de boldo sobre a germinação e índice mitótico de Allium cepa L. Arquivos do Instituto Biológico. 2006;73(1):79-82.
- Silva SAD, Ribeiro SG, Bender AEN, Timm FC, Garcias GDL, Martino-Roth MDG. Estudo da atividade mutagênica das plantas, Euphorbia milii Des Moulins e Ricinus communis L através do teste de Allium cepa L. Revista Brasileira de Farmacognosia. [Internet]. 2009 [acesso em Mar 28];19(2):418-422. doi: https://doi.org/10.1590/S0102-695X2009000300014
- Queires LCS, Rodrigues LEA. Quantificação das substâncias fenólicas totais em órgãos da aroeira Schinus Terebenthifolius (RADDI). Brazilian Archives of Biology and Technology. [Internet]. 1998 [acesso em Abr 5];41(2):0-0. doi: https://doi.org/10.1590/S1516-89131998000200012
- Soares SE. Ácidos fenólicos como antioxidantes. Revista de Nutrição. [Internet]. 2002 [acesso em 2022 Fev 15];15(1):71-81. doi: https://doi.org/10.1590/S1415-52732002000100008
- Pereira RJ, das Draças Cardoso M. Metabólitos secundários vegetais e benefícios antioxidantes. Journal of biotechnology and biodiversity. 2012;3(4):146-152.
- Dias MG, Canto-Dorow TS, Coelho APD, Tedesco SB. Efeito genotóxico e antiproliferativo de Mikania cordifolia (LF) Willd.(Asteraceae) sobre o ciclo celular de Allium cepa L. Revista Brasileira de Plantas Medicinais. [Internet]. 2014 [acesso em 2022 Mar 17];16(2):202-208. doi: http://dx.doi.org/10.1590/S1516-05722014000200006
- Ferreira FG, Regasini LO, Oliveira AMD, Campos JA, Silva DH, Cavalheiro AJ, et al. Avaliação de mutagenicidade e antimutagenicidade de diferentes frações de Pterogyne nitens (Leguminosae), utilizando ensaio de micronúcleo em Tradescantia pallida. Revista Brasileira de Farmacognosia. [Internet]. 2009 [acesso em 2022 Fev 16];19(1):61-67. doi: https://doi.org/10.1590/S0102-695X2009000100014
- Montagner C. Atividades antifúngica, citotóxica (células tumorais humanas) e hemolítica de cumarinas naturais e semi-sintéticas [Dissertação]. Florianópolis: Universidade Federal de Santa Catarina; 2007.
* Graduado em Ciências Biológicas na Universidade do Oeste de Santa Catarina.
† Mestranda em Biologia de Fungos, Algas e Plantas na Universidade Federal de Santa Catarina; Graduada em Ciências Biológicas pela Universidade do Oeste de Santa Catarina.
‡ (In memoriam) Mestra em Zootecnia pela Universidade Federal de Santa Maria; Professora do Curso de Ciências Biológicas da Universidade do Oeste de Santa Catarina.
§ Doutora em Produção Vegetal pela Universidade do Estado de Santa Catarina; Mestre em Botânica pela Universidade Federal do Paraná.