
Artigo de revisão
POLÍMEROS DE FRUTOSE: IMPORTÂNCIA PARA A NUTRIÇÃO E SAÚDE HUMANA
Polymers of fructose: importance for the nutrition and human health
https://doi.org/10.18593/eba.27168
Recebido em 30 de dezembro de 2020 / Aceito em 21 de fevereiro de 2022
Rita de Cassia Leone Figueiredo-Ribeiro* Rosemeire Aparecida Bom Pessoni†
Rosemeire Aparecida Bom Pessoni† Nair Massumi Itaya‡
Nair Massumi Itaya‡ Mauricio Batista Fialho§
Mauricio Batista Fialho§

Resumo:
Frutanos do tipo inulina são carboidratos solúveis não digeríveis, à base de frutose, encontrados em muitos vegetais utilizados na alimentação humana. Esses polímeros constituídos por ligações β-glicosídicas apresentam atividade prebiótica, estimulando de forma seletiva a multiplicação e atividade de bactérias intestinais benéficas. Esses micro-organismos, bem como os seus metabólitos resultantes da fermentação dos frutanos, têm sido associados a diversos efeitos positivos sobre a saúde e bem-estar como função intestinal, resposta imune, metabolismo, desenvolvimento ósseo, cognição e emoção. Além disso, esses carboidratos apresentam potencial na prevenção e melhoria de diversas condições patológicas. Desta forma, a presente revisão teve como objetivo levantar as evidências sobre os efeitos da suplementação de frutanos em diversos aspectos da saúde humana. Para tal, foi realizado o levantamento de estudos clínicos randomizados, duplo cego, placebo controlados, publicados entre os anos de 1995 e 2020, indexados nas bases de dados Pubmed, Web of Science, Scielo, Scopus e Lilacs. Diversos trabalhos demonstraram os benefícios dos frutanos sobre muitos aspectos da saúde e bem-estar, no entanto, mais estudos clínicos ainda são necessários para ampliar o conhecimento adquirido até o momento e preencher lacunas importantes existentes sobre o tema. Este conhecimento é essencial para determinar indicações e eventuais contraindicações em futuros protocolos terapêuticos.
Palavras-chave: Fibra solúvel. Prebiótico. Polímeros de frutose. Saúde e bem-estar.
Abstract:
Inulin-type fructans are soluble nondigestible carbohydrates based on fructose found in many plants used in human nutrition. These polymers constituted by β-glycosidic bonds have prebiotic activity by selectively stimulating the multiplication and activity of beneficial intestinal bacteria. These microorganisms, as well as their metabolites resulting from the fermentation of fructans, have been associated to several positive effects on health and well-being such as intestinal function, immune response, metabolism, bone development, cognition and emotion in addition to preventing or improving many pathological conditions. Thus, this review aimed at raise the evidence on the effects of fructan supplementation on different aspects of human health. Therefore, it was surveyed randomized, double-blind, placebo-controlled clinical trials, published between 1995 and 2020 indexed in the databases Pubmed, Web of Science, Scielo, Scopus and Lilacs. Several studies demonstrated the benefits of fructans on many aspects of health and well-being, however, more clinical studies are necessary in order to improve the knowledge acquired until now and to fill gaps that still exist in available literature. This knowledge is essential to determine indications and possible contraindications in future therapeutic protocols.
Keywords: Soluble fiber. Prebiotic. Polymers of fructose. Health and well-being.
@Autor correspondente: Mauricio Batista Fialho, Servidor da Universidade Federal do ABC, Avenida dos Estados, 5001, CEP 09210-580, Santo André, SP, Brasil; https://orcid.org/0000-0002-0378-0730; fialhomb@hotmail.com
1 INTRODUÇÃO
Tradicionalmente, alimento pode ser entendido apenas como fonte de energia e nutrientes necessários para a sobrevivência. No entanto, tem sido dado maior importância ao conceito de alimento funcional que, além de fornecer nutrição básica promove saúde, previne doenças e atua na manutenção do bem-estar físico e mental. Desta forma, a demanda por alimentos funcionais tem crescido consideravelmente1. Têm se destacado fibras alimentares solúveis como os frutanos, que são polímeros constituídos por unidades de frutose unidas através de ligações β-glicosídicas, podendo possuir ou não uma molécula terminal de glicose unida à cadeia por meio de ligação α-(1, 2)2.
Os frutanos foram descobertos em 1804 pelo farmacologista alemão Valentine Rose que reportou “uma substância peculiar” em extratos de raiz de Inula helenium (família Asteraceae) que, em 1818, foi denominada inulina por Thompson. Desde então, frutanos de diferentes tipos foram encontrados como carboidratos de reserva em aproximadamente 45.000 espécies de Angiospermas3, incluindo muitas plantas empregadas para fins alimentícios e medicinais como chicória (Cichorium intybus), alcachofra, alho, aspargos, banana, beterraba, cebola, tomate, bardana, trigo e yacon. O conteúdo de frutanos em % de massa fresca pode variar de menos de 1% como em banana até 20% como em raiz de chicória e yacon. Além das plantas, os frutanos também são produzidos por bactérias e fungos4. A vegetação brasileira tem grande potencial como fonte de plantas ricas em frutanos. Em um levantamento realizado em plantas herbáceas da família Asteraceae mais representativas do Cerrado foi verificado que 60% das espécies estudadas acumulavam frutanos em seus órgãos subterrâneos2. Em outro estudo, o levantamento realizado em plantas das famílias Asteraceae e Amaranthaceae, encontradas na vegetação de Campos Rupestres, foi constatado que todas as espécies avaliadas apresentavam frutanos como principal carboidrato de reserva5.
Os frutanos podem ser classificados com base no tipo de ligação β-glicosídica que une os resíduos de frutose (Figura 1). Os frutanos do tipo inulina são polímeros lineares em que as unidades frutosil são unidas através de ligação β-(2, 1), enquanto os frutanos do tipo levano (ou fleanos) apresentam unidades frutosil unidas através de ligações β-(2, 6). Os frutanos do tipo misto (ou graminanos) são polímeros ramificados com unidades frutosil unidas através de ligações β-(2, 1) e β-(2, 6). Além disso, também são encontrados na natureza frutanos neoserie da inulina e neoserie do levano que apresentam uma unidade de glicose internamente na estrutura6-8.
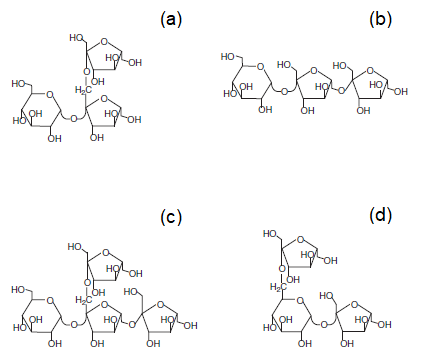
Figura 1 – Estruturas dos oligossacarídeos precursores de diferentes tipos de frutanos. (a) 1-cestose (tipo inulina); (b) 6-cestose (tipo levano); (c) bifurcose (tipo misto); (d) neocestose (tipo neoserie do levano). Adaptado de Velázquez-Hernández et al.8
Os frutanos do tipo inulina são os mais conhecidos e estudados sendo que a maior parte desses frutanos é produzida em escala industrial a partir de raízes de chicória empregando extração com água quente. Após a extração é obtida a inulina nativa que se trata de uma mistura de oligômeros e polímeros com grau de polimerização (GP) variando entre 2 e 60 (GP médio = 12). O tamanho da cadeia da inulina nativa pode ser reduzido através do emprego de endo-inulinases obtendo-se a oligofrutose, um produto com GP variando entre 2 e 8 (GP médio = 4). O termo fruto-oligossacarídeo (FOS) é geralmente utilizado para frutanos de cadeias curtas (GP 3-5), sintetizados a partir da sacarose, empregando frutosiltransferases, ou β-frutofuranosidades (invertases) com atividade de transfrutosilação. Os FOS do tipo inulina são principalmente representados por 1-kestose (GF2), nistose (GF3) e frutofuranosil nistose (GF4) em que as unidades de frutose (F) são unidas a uma unidade de glicose (G) terminal através de ligação β-(2, 1)4,6,9.
Devido à configuração β no carbono 2 anomérico os frutanos não são hidrolisados pelas enzimas digestivas humanas e absorvidos no intestino, no entanto, esses carboidratos são considerados prebióticos pois são substratos seletivos para um limitado grupo de bactérias intestinais que proporcionam benefícios para a saúde6,10. Foi demonstrado que os frutanos são completamente fermentados por bactérias como Bifidobacterium e Lactobacillus e as moléculas produzidas por esses micro-organismos podem atuar positivamente sobre o sistema digestivo, sistema imune, metabolismo, além de reduzir processos infecciosos e inflamatórios, entre outros benefícios11.
Portanto, a presente revisão teve como objetivo examinar as evidências em relação à suplementação alimentar com frutanos do tipo inulina na promoção da saúde e como alternativa terapêutica no tratamento de doenças. Para tal, foi realizado o levantamento de estudos clínicos randomizados, duplo cego, placebo controlados, publicados entre os anos de 1995 e 2020 e indexados nas bases de dados Pubmed, Web of Science, Scielo, Scopus e Lilacs. Para as buscas foram utilizadas palavras-chave principais como frutano, fructooligossacarídeo ou inulina combinadas a palavras-chave secundárias como atividade prebiótica, microbiota intestinal, função intestinal, desenvolvimento ósseo, câncer, sistema nervoso central, sistema imune ou metabolismo. Esses descritores e suas variações foram pesquisados em inglês e português.
2 BENEFÍCIOS NUTRICIONAIS E DE SAÚDE
2.1 ATIVIDADE PREBIÓTICA
A dieta é considerada um dos principais fatores que afetam os micro-organismos residentes do intestino, sendo que fibras alimentares (carboidratos não digeríveis) são particularmente importantes na modificação da composição e atividade da microbiota intestinal. Os frutanos do tipo inulina, extraídos a partir de raízes de chicória, são as fibras alimentares mais bem estudadas, e reconhecidas como prebióticos pela International Scientific Association of Probiotics and Prebiotics (Isapp). Atualmente, a Isapp define prebióticos como sendo substratos seletivamente utilizados por alguns micro-organismos do hospedeiro, conferindo a esses, diversos benefícios à saúde10.
Principalmente com base no sequenciamento do gene 16S rRNA estudos clínicos têm avaliado as alterações na composição da microbiota intestinal de indivíduos que consumiram inulina, oligofrutose ou FOS em doses e períodos de tratamento variados. Os resultados indicaram aumento consistente de Bifidobacterium, além de mostrarem aumento na abundância dos gêneros Lactobacillus, Anaerostipes e Faecalibacterium, e redução de Bacteroides após a suplementação com estes compostos12,13.
Segundo Closa-Monasterolo et al.14, recém-nascidos que receberam nos quatro primeiros meses de vida formulação de leite suplementada com inulina+oligofrutose apresentaram maior contagem de Bifidobacterium e menor contagem de Bacteroides e Enterobacteriaceae, apresentando, portanto, microbiota intestinal similar à dos recém-nascidos que receberam leite materno. Por outro lado, os recém-nascidos que foram alimentados com a formulação padrão tiveram menor contagem de Bifidobacterium e maior contagem de Bacteroides e Enterobacteriaceae.
Cerca de 90% da inulina é utilizada pelas bactérias presentes no cólon15. A fermentação microbiana dos frutanos gera ácidos graxos de cadeia curta (AGCC) como acetato, propionato e butirato. Esses metabólitos considerados chave na interação microbiota-hospedeiro são absorvidos pelas células epiteliais do intestino e podem atuar de maneira local e sistêmica afetando positivamente a fisiologia do hospedeiro16. A inulina de cadeia curta é metabolizada principalmente na porção proximal do cólon, enquanto a inulina de cadeia longa é metabolizada na porção mais distal. Portanto, como esses frutanos são metabolizados em diferentes partes do intestino grosso, acredita-se que o emprego da mistura de inulina de cadeia curta e longa pode maximizar seu efeito prebiótico17.
2.2 FUNÇÃO INTESTINAL E CÂNCER COLORRETAL
O funcionamento regular do intestino pode ser mantido ou melhorado pelo consumo de fibras alimentares afetando, portanto, profundamente a qualidade de vida. Segundo de Vries et al.18, foi verificado através de ensaios clínicos que voluntários que consumiram regularmente frutanos de cadeia curta (GP<10) apresentaram aumento significativo na frequência de evacuações quando comparado aos voluntários que não receberam suplementação, independentemente de apresentarem ou não algum tipo de comprometimento intestinal. Também foi verificado efeito positivo dos frutanos na consistência das fezes. Os estudos também mostraram que o efeito positivo dos frutanos aumentou proporcionalmente em relação ao aumento da dose ingerida, no entanto, sem haver melhora adicional com doses a partir de 18 g/dia. Os autores não verificaram efeito significativo em relação ao consumo de frutanos de cadeia longa (GP ≥ 10).
A maioria dos estudos avaliaram os frutanos na prevenção e tratamento do câncer colorretal. Experimentos em animais têm demonstrado que inulina e oligofrutose apresentam efeito anticarcinogênico e potencializam o tratamento do câncer colorretal. A maior produção de AGCC, em especial butirato, pelas bactérias intestinais, tem sido apontada como um dos principais mecanismos envolvidos na atividade protetora dos frutanos19,20. Em humanos, embora o consumo de inulina, oligofrutose e FOS possa aumentar os níveis de butirato fecal, não têm sido verificadas alterações significativas em biomarcadores de risco de câncer colorretal como proliferação celular e apoptose. Portanto, os estudos clínicos até o momento não tiveram sucesso em demonstrar a associação entre consumo de frutanos e redução no risco de câncer colorretal19-22. No entanto, o papel dos frutanos no controle tumoral ainda precisa ser melhor investigado.
2.3 ALTERAÇÕES METABÓLICAS
Nos últimos anos, evidências têm sugerido que o desequilíbrio da microbiota intestinal possui papel fundamental no desenvolvimento de alterações metabólicas incluindo dislipidemia, sobrepeso ou obesidade e diabetes mellitus tipo 2. Segundo Liu et al.23, ensaios clínicos demonstraram que o consumo de frutanos do tipo inulina pode reduzir os níveis de colesterol de lipoproteína de baixa densidade (LDL-C) em pacientes saudáveis e portadores de anormalidades metabólicas. Em relação a portadores de diabetes, além de reduzir o LDL-C, o consumo dos frutanos foi positivamente correlacionado com a redução da insulina e glicose de jejum e aumento dos níveis de colesterol de lipoproteína de alta densidade (HDL-C).
Segundo Atef et al.24, mulheres obesas, portadoras de diabetes tipo 2 e doença hepática gordurosa não alcoólica que consumiram por 4 semanas 6 g/dia de inulina apresentaram redução significativa nos níveis séricos de glicose em jejum, colesterol total e triglicerídeos. Também houve redução nos níveis das enzimas hepáticas aspartato aminotransferase e alanina aminotransferase. Por outro lado, o nível de HDL-C aumentou significativamente. Além disso, foi verificado melhora da sensibilidade à insulina e diminuição da resistência à insulina. De acordo com os autores, os efeitos positivos sobre os parâmetros avaliados mostram que a inulina melhorou o metabolismo de lipídios e apresentou efeito antidiabético e hepatoprotetor, indicando, portanto, o papel benéfico desses frutanos em pacientes obesos portadores de diabetes e doenças hepáticas.
Apesar de os mecanismos de ação desses prebióticos não estarem completamente elucidados, dados experimentais indicam que os frutanos seriam capazes de reduzir a síntese de lipídio pelo fígado, por meio da inibição da expressão de enzimas lipogênicas, resultando em secreção reduzida de lipoproteínas de muito baixa densidade (VLDL) ricas em triglicérides via produção de AGCC ou via modulação da insulinemia. Outro provável mecanismo é a atuação AGCC na redução da atividade da β-(OH)-metilglutarilCoA-redutase, enzima chave envolvida na síntese do colesterol25.
2.4 COGNIÇÃO E DOENÇAS NEUROLÓGICAS
O papel que o sistema nervoso central (SNC) exerce na regulação das funções gastrointestinais é amplamente reconhecido. Todavia, apenas mais recentemente tem sido dado maior importância ao papel que o sistema nervoso entérico pode exercer sobre o SNC. O intestino, aliado à sua estrutura neuronal, à comunidade microbiana e aos seus metabolitos, possui a capacidade de estabelecer comunicação através do eixo cérebro-intestino e afetar diversas funções neurológicas26.
Segundo Aizawa et al.27, baixas contagens de Bifidobacterium e/ou Lactobacillus foram associadas a transtornos depressivos e testes clínicos apontaram que o emprego destas bactérias como probióticos foi capaz de reduzir os sintomas associados à ansiedade, depressão e estresse28-31. Pesquisas que avaliaram os efeitos psicofisiológicos dos frutanos ainda são limitadas. No primeiro estudo, que avaliou o efeito de prebióticos sobre a função cerebral, indivíduos saudáveis que consumiram galacto-oligossacarídeos (5,5 g/dia) durante 3 semanas apresentaram níveis reduzidos de cortisol, um hormônio biomarcador de estresse, além de redução da vigilância em resposta a estímulos emocionais negativos, sugerindo assim menor propensão à ansiedade e depressão quando comparado aos indivíduos que receberam placebo. Por outro lado, os autores verificaram que o consumo de FOS não resultou em alterações significativas32. Em outro estudo, indivíduos portadores da síndrome do intestino irritável que consumiram FOS (5 g/dia) durante 4 semanas apresentaram maior contagem de Bifidobacterium e melhora no índice que avalia a sensação de ansiedade e depressão quando comparado aos indivíduos que receberam placebo33.
Nos últimos anos surgiram evidências de que o desequilíbrio da comunidade microbiana intestinal estaria relacionado à ocorrência de doenças neurodegenerativas. Pessoas portadoras de Alzheimer, Parkinson, esclerose multipla e esclerose lateral amiotrofica apresentaram maior abundância de bactérias como Akkermansia spp, Lachnospira spp e Bilophila spp, enquanto o número de bactérias produtoras de butirato foi significativamente reduzido34. No entanto, estudos adicionais ainda são necessários para estabelecer uma relação causal entre disfunção da microbiota intestinal e doenças neurológicas. Além disso, apesar dos frutanos possuírem papel na redução da resposta inflamatória, não foi investigado até o momento o efeito desses prebióticos na prevenção ou controle de doenças neurodegenerativas. Esse conhecimento é essencial para o eventual emprego de prebióticos como uma opção no tratamento de diversas condições neurológicas35.
As evidências obtidas até o momento demonstram que os mecanismos que permitem a comunicação entre a microbiota intestinal e o sistema nervoso são múltiplos e complexos. Um dos fatores-chave nessa comunicação parece ser a produção de AGCC a partir da fermentação de substâncias prebióticas por Bifidobacterium e Lactobacillus. Esses metabólitos interagem com células enteroendócrinas que são estimuladas a liberar hormônios como o peptídeo tirosina tirosina (PYY), peptídeo semelhante ao glucagon (GLP-1) e colecistocinina (CCK). Esses hormônios intestinais entram na circulação e migram para o SNC onde iniciam cascatas neuroquímicas e de sinalização, resultando em mudanças comportamentais. Os AGCC também se ligam a receptores entéricos como o receptor toll-like (TLR) e o receptor acoplado à proteína G (GPCR) que modulam a ativação de respostas anti-inflamatórias antagonizando citocinas pró-inflamatórias. O eixo hipotálamo-pituitária-adrenal, que regula a produção de cortisol ou atua como um modificador epigenético no cérebro, também pode ser afetado por AGCC. Os prebióticos favorecem a produção microbiana de neurotransmissores que modulam a atividade cerebral via nervo vago, como ácido gamaminobutírico, dopamina, serotonina e acetilcolina. Além disso, a interação direta entre prebióticos e receptores entéricos do hospedeiro, independente da microbiota intestinal, também tem sido investigada como um fator atuante na modificação das funções cerebrais36.
2.5 SAÚDE ÓSSEA
A fermentação de frutanos pela microbiota intestinal gera produtos metabólicos que podem aumentar a absorção de cálcio e outros minerais e, consequentemente, favorecer o desenvolvimento ósseo em adolescentes, além de prevenir ou reverter a perda óssea em condições patológicas como a osteoporose37. Segundo Abrams et al.38, crianças entre 9 e 13 anos que consumiram durante 1 ano uma mistura de inulina+oligofrutose (8 g/dia) apresentaram maior absorção intestinal de cálcio em relação ao grupo controle (37,7 ±2,1% vs 31,7 ±2,3%), resultando também em maior nível de conteúdo mineral ósseo e maior densidade mineral óssea. Além disso, foram observados efeitos positivos dos frutanos em mulheres na pós-menopausa, fase em que há perda óssea devido à deficiência de estrógeno. O grupo que consumiu a mistura de inulina+oligofrutose (10 g/dia) durante 6 semanas, apresentou maior absorção de cálcio e magnésio, quando comparado ao grupo que consumiu placebo [Ca (5,1 ±2,1% vs -3,3 ±2,2%) e Mg (5,2 ±2,9% vs -4,3 ±3,0%)] e apresentaram alterações nos marcadores de remodelação óssea39. Crianças com média etária de 10 anos, portadoras de doença celíaca, que adotaram por 3 meses uma dieta livre de glúten suplementada com inulina+oligofrutose (10 g/dia) apresentaram maior taxa de formação óssea e menor taxa de absorção óssea quando comparadas às crianças que adotaram a dieta livre de glúten sem os frutanos40.
Outros estudos também observaram o efeito positivo da administração de inulina+oligofrutose sobre a absorção de cálcio e o metabolismo ósseo41-44. No entanto, também há relatos de que o consumo de oligofrutose ou inulina isoladamente não resultou em aumento significativo na absorção de cálcio42,45-46. A combinação de oligofrutose e inulina deve resultar em ação sinergística uma vez que a fermentação desses frutanos ocorrerá em toda a extensão do cólon, resultando em maior área por onde o cálcio será absorvido47.
Acredita-se que frutanos podem contribuir no aumento da absorção de minerais por meio da redução do pH intestinal uma vez que a fermentação desses carboidratos pelos micro-organismos produz AGCC e outros ácidos orgânicos resultando na queda do pH no lúmen intestinal48. De fato, o cálcio, na forma mineral ou em associação com outros componentes, deve estar ionizado para que esteja solúvel e possa ser melhor absorvido passivamente pelas células intestinais. Além disso, os AGCC também contribuem para a absorção do cálcio através de um mecanismo da troca de H+ intracelular pelo Ca2+ luminal. O butirato produzido a partir da fermentação de frutanos também pode modular o transporte ativo de cálcio, induzindo a expressão de proteínas ligadoras de cálcio. Por fim, os AGCC também podem estimular a proliferação celular na mucosa intestinal resultando em maior área absortiva9,49-50.
2.6 IMUNIDADE E ALERGIAS
Alguns trabalhos estudaram a hipótese de que a ingestão de prebióticos afeta a resposta imune específica e não específica. Idosos com média etária de 85 anos, que consumiram FOS (8 g/dia) durante 3 semanas, apresentaram maior contagem de bifidobactérias, sendo observado aumento do número de linfócitos CD4+ e CD8+ no sangue periférico. No entanto, houve redução da atividade fagocitária de granulócitos e monócitos e menor expressão da citocina pró-inflamatória interleucina 6 (IL-6) em monócitos51. Segundo os autores, o menor número de bactérias patogênicas devido à atividade prebiótica dos FOS pode ter reduzido processos inflamatórios como fagocitose e produção de citocinas. Por outro lado, um estudo mostrou que idosos que consumiram oligofrutose+inulina (6 g/dia) durante 3 semanas não apresentaram alterações significativas nos níveis de imunoglobulinas no soro (IgA, IgG e IgM) e de IgA secretora na saliva em relação ao controle. O consumo dos frutanos também não afetou a produção de anticorpos nos indivíduos após receberem as vacinas contra influenza e pneumococos52. Segundo Duggan et al.53, o consumo de oligofrutose por bebês com idade entre 6 e 12 meses não resultou em alterações na prevalência de infecções e na resposta à vacinação contra influenza.
Adultos asmáticos que consumiram inulina (12 g/dia) durante 7 dias apresentaram melhoria no controle da asma e redução da inflamação eosinófílica das vias aéreas. Também ocorreu inibição na expressão da enzima HDAC9 em células do escarro que, segundo os autores, é o provável mecanismo envolvido nos efeitos observados54.
Outros estudos avaliaram a resposta imunológica em idosos que consumiram suplementações contendo inulina e/ou oligofrutose, e vitaminas e minerais55-57. Os voluntários que consumiram as suplementações apresentaram melhoria nos parâmetros gerais de resposta imune, incluindo melhor resposta a vacinas contra influenza e pneumococos, e menor incidência de infecções. Segundo Lecerf et al.58, adultos jovens que ingeriram diariamente 4 g da mistura inulina+xilo-oligossacarídeos (3:1) apresentaram maior contagem de Bifidobacterium, maior nível de IgA secretora no intestino e menor reação pró-inflamatória. Também foram observados efeitos benéficos da mistura oligofrutose+galacto-oligossacarídeos (9:1) (8 g/l) sobre o sistema imunológico de bebês que apresentavam maior propensão a alergias59,60. De acordo com os autores, o consumo dos prebióticos nos primeiros 6 meses de vida promoveu a formação de microbiota rica em Bifidobacterium e resultou em menor incidência de dermatite atópica, urticária alérgica e broncoespasmos em relação ao grupo que recebeu placebo. Também foi relatado menos episódios de infecções respiratórias, febre e prescrições de antibióticos. Dando continuidade a esses estudos, segundo Arslanoglu et al.61, o monitoramento realizado por cinco anos das crianças que consumiram oligofrutose+galacto-oligossacarídeos nos primeiros 6 meses de vida mostrou menor incidência de manifestações alérgicas.
Apesar do número limitado de testes clínicos e alguns resultados conflitantes, os frutanos parecem exercer papel significativo na resposta imunológica. A maioria dos estudos avaliou inulina ou oligofrutose em combinação com outros prebióticos, minerais, vitaminas, entre outros nutrientes, portanto, o papel dos frutanos não pôde ser avaliado independentemente nesses casos. Além disso, o emprego de metodologias variadas e a heterogeneidade dos indivíduos avaliados ainda são um desafio para o melhor entendimento sobre a efetividade dos frutanos na modulação do sistema imune.
3 SEGURANÇA E ASPECTOS REGULATÓRIOS
As autoridades reguladoras dos Estados Unidos (U.S. Food and Drug Administration, FDA) e União Europeia (European Food Safety Authority, EFSA)62 consideram que inulina e FOS são seguros para o consumo humano e capazes de trazer benefícios à saúde. Segundo a EFSA63, produtos contendo inulina ou frutanos do tipo inulina, podem empregar em seus rótulos a alegação de manutenção da função intestinal normal com base no consumo diário de 12 g de inulina. A FDA, mais recentemente, incluiu os frutanos do tipo inulina na lista de carboidratos solúveis ou insolúveis não digeríveis cujo consumo comprovadamente proporciona efeitos fisiológicos benéficos para a saúde humana64. No Brasil, segundo uma publicação da Agência Nacional de Vigilância Sanitária (ANVISA) sobre “Alegações de Propriedades Funcionais e ou de Saúde”, FOS ou inulina são considerados prebióticos que contribuem para o equilíbrio da flora intestinal, e ainda, que seu consumo deve estar associado a uma alimentação equilibrada e hábitos de vida saudáveis. A referida alegação pode ser empregada em produtos desde que o fabricante recomende consumo diário capaz de fornecer no mínimo 5 g de FOS ou inulina. Também é estabelecido que cada porção do produto contenha 2,5 g de FOS ou inulina. Ainda, segundo a ANVISA, a recomendação diária não deve ultrapassar 30 g65.
Em relação a eventuais efeitos adversos, o primeiro sintoma observado em indivíduos saudáveis que consomem doses crescentes de FOS é a flatulência excessiva (30 g/dia), seguido de sons intestinais e distensão abdominal (40 g/dia) e, finalmente, cólica abdominal e diarreia quando a dosagem diária de FOS atinge 50 g/dia66. Segundo Bonnema et al.67, consumo de 10 g/dia de inulina ou 5 g/dia de oligofrutose foram bem tolerados pelos indivíduos avaliados. No entanto, doses maiores resultaram em sintomas gastrointestinais leves, sendo reportados principalmente flatulência e distensão abdominal. De modo geral, nenhum sintoma gastrointestinal é observado para doses diárias de até 10-12 g de frutanos, mesmo em pessoas com queixas prévias de sintomas gastrointestinais18,68-70.
Conforme já exposto, diversos estudos em humanos têm demonstrado os benefícios dos frutanos para a saúde, sem apresentar efeitos negativos ou apenas efeitos indesejáveis leves. No entanto, alguns resultados conflitantes já foram relatados atribuindo efeitos colaterais importantes ao uso de frutanos. De acordo com Chambers et al.71, o consumo de alta dose de inulina (20 g/dia) aumentou o acúmulo de lipídio intra-hepático em pessoas portadoras de doença hepática gordurosa não-alcoólica. Outros estudos realizados em animais identificaram efeitos adversos relacionados ao consumo de inulina e oligofrutose11, como piora do quadro clínico de ratos e camundongos portadores de doenças inflamatórias no intestino72,73. Portanto, embora o consumo de frutanos seja considerado seguro deve-se ter atenção à dose consumida e estudos futuros devem investigar eventuais efeitos negativos e determinar contraindicações para portadores de doenças específicas, caso necessário.
4 CONCLUSÃO
Diversos trabalhos demonstraram os benefícios relacionados ao consumo de frutanos do tipo inulina sobre a saúde e bem-estar, abrindo assim novas perspectivas no campo da farmacologia nutricional. No entanto, mais ensaios clínicos devem ser conduzidos com o objetivo de fortalecer as evidências existentes até o momento. Tal conhecimento é essencial para o desenvolvimento de formulações e estabelecimento de dosagens, a fim de modular a microbiota intestinal, bem como determinar eventuais contra contraindicações.
AGRADECIMENTOS
Os autores agradecem à Pesquisadora Dra. Maria Angela M. Carvalho (Instituto de Botânica de São Paulo) pela revisão crítica e sugestões sobre o manuscrito.
REFERÊNCIAS
- Birch CS, Bonwick GA. Ensuring the future of functional foods. Int. J. Food Sci. Technol. 2019; 54(5):1467-85.
- Figueiredo-Ribeiro RCL, Simões K, Fialho MB, Pessoni RAB, Braga MR, Gaspar M. Potencial of the filamentous fungi from the brazilian cerrado as producers of soluble fibers. In: Benkeblia N, organizador. Polysaccharides Natural Fibers in Food and Nutrition. Boca Raton: CRC Press. 2014:131-48.
- Hendry GAF. Evolutionary origins and natural functions of fructans. A climatological, biogeographic and mechanistic appraisal. New Phytol. 1993; 123(1):3-14.
- Tungland B. Nondigestible fructans as prebiotics. In: Tungland B., organizador. Human Microbiota in Health and Disease. Academic Press. 2018:349-79.
- Joaquim EO, Silva TM, Figueiredo-Ribeiro RCL, Moraes MG, Carvalho MAM. Diversity of reserve carbohydrates in herbaceous species from Brazilian campo rupestre reveals similar functional traits to endure environmental stresses. Flora, 2018; 238: 201-09.
- Roberfroid MB. Inulin-type fructans: Functional food ingredients. J. Nutr. 2007; 137(S11):2493S-502.
- Benkeblia N. Fructooligosaccharides and fructans analysis in plants and food crops. J. Chromatogr. A. 2013; 1313:54-61.
- Velazquez-Hernandez ML, Baizabal-Aguirre VM, Bravo-Patino A, Cajero-Juarez M, Chavez-Moctezuma MP, Valdez-Alarcon JJ. Microbial fructosyltransferases and the role of fructans. J. Appl. Microbiol. 2009; 106:1763-78.
- Bosscher D. Fructan prebiotics derived from inulin. In: Charalampopoulos D, Rastall, RA, organizadores. Prebiotics and Probiotics Science and Technology. New York: Springer. 2009:163-205.
- Gibson GR, Hutkins R, Sanders ME, Prescott SL, Reimer RA, Salminen SJ, et al. Expert consensus document: The international scientific association for probiotics and prebiotics (ISAPP) consensus statement on the definition and scope of prebiotics. Nat. Rev. Gastroenterol. Hepatol. 2017; 14(8):491-502.
- Man S, Liu T, Yao Y, Lu Y, Ma L, Lu F. Friend or foe? The roles of inulin-type fructans. Carbohydr. Polym. 2021; 252:117155.
- Le Bastard Q, Chapelet G, Javaudin F, Lepelletier D, Batard E, Montassier E. The effects of inulin on gut microbial composition: A systematic review of evidence from human studies. Eur. J. Clin. Microbiol. Infect. Dis. 2020; 39(3):403-13.
- Swanson KS, de Vos WM, Martens EC, Gilbert JA, Menon RS, Soto-Vaca A, et al. Effect of fructans, prebiotics and fibres on the human gut microbiome assessed by 16S rRNA-based approaches: a review. Benef Microbes. 2020; 11(2):101-29.
- Closa-Monasterolo R, Gispert-Llaurado M, Luque V, Ferre N, Rubio-Torrents C, Zaragoza-Jordana M, et al. Safety and efficacy of inulin and oligofructose supplementation in infant formula: results from a randomized clinical trial. Clin Nutr. 2013; 32(6):918-27.
- Cherbut C. Inulin and oligofructose in the dietary fibre concept. Br. J. Nutr. 2002; 87(S2):S159-S62.
- Thursby E, Juge N. Introduction to the human gut microbiota. Biochem J. 2017; 474(11):1823-36.
- Gibson GR. Functional foods: probiotics and prebiotics. Culture. 2007; 28(2):1-7.
- de Vries J, Le Bourgot C, Calame W, Respondek F. Effects of β-fructans fiber on bowel function: A systematic review and meta-analysis. Nutrients. 2019; 11(1):91.
- Limburg PJ, Mahoney MR, Ziegler KL, Sontag SJ, Schoen RE, Benya R, et al. Cancer Prevention Network. Randomized phase II trial of sulindac, atorvastatin, and prebiotic dietary fiber for colorectal cancer chemoprevention. Cancer Prev. Res. (Phila). 2011; 4(2):259-69.
- Rao M, Gao C, Hou J, Gu J, Law BYK, Xu Y. Non-Digestible Carbohydrate and the risk of colorectal neoplasia: A systematic review. Nutr. Cancer. 2020:1-14.
- Boutron-Ruault MC, Marteau P, Lavergne-Slove A, Myara A, Gerhardt MF, Franchisseur C, Bornet F; et al. Effects of a 3-mo consumption of short-chain fructo-oligosaccharides on parameters of colorectal carcinogenesis in patients with or without small or large colorectal adenomas. Nutr Cancer. 2005; 53(2):160-8.
- Mazraeh R, Azizi-Soleiman F, Jazayeri SMHM, Noori SMA. Effect of inulin-type fructans in patients undergoing cancer treatments: A systematic review. Pak. J. Med. Sci. 2019; 35(2):575-80.
- Liu F, Prabhakar M, Ju J, Long H, Zhou HW. Effect of inulin-type fructans on blood lipid profile and glucose level: A systematic review and meta-analysis of randomized controlled trials. Eur. J. Clin. Nutr. 2017; 71(1):9-20.
- Atef M, El-Matty DA, Habib DF, Nicola WG, Saleh S, Hanna H. Ameliorative effects of inulin on non alcoholic fatty liver disease associated with type 2 diabetes mellitus in obese women. J. Innov. Pharm. Biol. Sci. 2020; 7(2):6-16.
- Fortes RC, Muniz LB Efeitos da suplementação dietética com frutooligossacarídeos e inulina no organismo humano: Estudo baseado em evidências. Comun. ciênc. saúde 2009; 20(3):241-52.
- Vuong HE, Hsiao EY. Gut microbes join the social network. Neuron. 2019; 101(2):196-8.
- Aizawa E, Tsuji H, Asahara T, Takahashi T, Teraishi T, Yoshida S, et al. Possible association of Bifidobacterium and Lactobacillus in the gut microbiota of patients with major depressive disorder. J. Affect. Disord. 2016; 202:254-7.
- Huang R, Wang K, Hu J. Effect of probiotics on depression: A Systematic review and meta-analysis of randomized controlled trials. Nutrients. 2016; 8(8):483.
- Sarkar A, Lehto SM, Harty S, Dinan TG, Cryan JF, Burnet PWJ. Psychobiotics and the manipulation of bacteria-gut-brain signals. Trends Neurosci. 2016; 39(11):763-81.
- Wallace CJK, Milev R. The effects of probiotics on depressive symptoms in humans: A systematic review. Ann. Gen. Psychiatry. 2017:16-14.
- Taylor AM, Holscher HD. A review of dietary and microbial connections to depression, anxiety, and stress. Nutr. Neurosci. 2020; 23(3):237-50.
- Schmidt K, Cowen PJ, Harmer CJ, Tzortzis G, Errington S, Burnet PWJ. Prebiotic intake reduces the waking cortisol response and alters emotional bias in healthy volunteers. Psychopharmacology. 2015; 232(10):1793-801.
- Azpiroz F, Dubray C, Bernalier-Donadille A, Cardot JM, Accarino A, Serra J, et al. Effects of scFOS on the composition of fecal microbiota and anxiety in patients with irritable bowel syndrome: a randomized, double blind, placebo controlled study. Neurogastroenterol. Motil. 2017; 29(2).
- Sasmita AO. Modification of the gut microbiome to combat neurodegeneration. Rev Neurosci. 2019; 30(8):795-805.
- Barbosa PM, Barbosa ER. The gut brain-axis in neurological diseases. Int. J. Cardiovasc. Sci. 2020; 33(5):528-36.
- Kao AC, Harty S, Burnet PW. The influence of prebiotics on neurobiology and behavior. Int. Rev. Neurobiol. 2016; 131:21-48.
- Zaiss MM, Jones RM, Schett G, Pacifici R. The gut-bone axis: How bacterial metabolites bridge the distance. J. Clin. Investig. 2019; 129(8):3018-28.
- Abrams S, Griffin I, Hawthorne K, Liang L, Gunn S, Darlington G, et al. Combination of prebiotic short and long-chain inulin-type fructans enhances calcium absorption and bone mineralization in young adolescents. Am. J. Clin. Nutr. 2005; 82(2):471-6.
- Holloway L, Moynihan S, Abrams S, Kent K, Hsu A, Friedlander A. Effects of oligofructose-enriched inulin on intestinal absorption of calcium and magnesium and bone turnover markers in postmenopausal women. Br. J. Nutr. 2007; 97(2):365-72.
- Drabińska N, Jarocka-Cyrta E, Złotkowska D, Abramowicz P, Krupa-Kozak U. Daily oligofructose-enriched inulin intake impacts bone turnover markers but not the cytokine profile in pediatric patients with celiac disease on a gluten-free diet: Results of a randomised, placebo-controlled pilot study. Bone. 2019; 122:184-92.
- van den Heuvel EG, Muys T, van Dokkum W, Schaafsma G. Oligofructose stimulates calcium absorption in adolescents. Am. J. Clin. Nutr. 1999; 69(3):544-8.
- Griffin I, Davila P, Abrams S. Non-digestible oligosaccharides and calcium absorption in girls with adequate calcium intakes. Br. J. Nutr. 2002; 87(S2):S187-S91.
- Griffin I, Hicks P, Heaney R, Abrams S. Enriched chicory inulin increases calcium absorption mainly in girls with lower calcium absorption. Nutr. Res. 2003; 23(7):901-9.
- Souza MCC, Lajolo FM, Martini LA, Correa NB, Dan MC, Menezes EW. Effect of oligofructose-enriched inulin on bone metabolism in girls with low calcium intakes. Br. J. Nutr. 2010; 53(1):193-201.
- van den Heuvel EG, Schaafsma G, Muys T, van Dokkum W. Nondigestible oligosaccharides do not interfere with calcium and nonheme-iron absorption in young, healthy men. Am. J. Clin. Nutr. 1998; 67(3):445-51.
- Tahiri M, Tressol J, Arnaud Y, Bornet F, Bouteloup-Demange C, Feillet-Coudray C, et al. Effect of short-chain fructooligosaccharides on intestinal calcium absorption and calcium status in postmenopausal women: A stable-isotope study. Am. J. Clin. Nutr. 2003; 77(2):449-57.
- Coudray C, Tressol JC, Gueux E, Rayssiguier Y. Effects of inulin-type fructans of different chain length and type of branching on intestinal absorption and balance of calcium and magnesium in rats. Eur. J. Nutr. 2003; 42(2):91-8.
- Coxam V. Inulin-type fructans and bone health: State of the art and perspectives in the management of osteoporosis. Br. J. Nutr. 2005; 93(S1):S111-S23.
- Scholz-Ahrens K, Schrezenmeir J. Inulin, oligofructose and mineral metabolism: experimental data and mechanism. Br. J. Nutr. 2002; 87(S2):S179-S86.
- Scholz-Ahrens K, Schrezenmeir J. Inulin and oligofructose and mineral metabolism: The evidence from animal trials. J. Nutr. 2007; 137(S11):S2513-S23.
- Guigoz Y, Rochat F, Perruisseau-Carrier G, Rochat I, Schiffrin EJ. Effects of oligosaccharide on the faecal flora and non-specific immune system in elderly people. Nutr Res. 2002; 22(1-2):13-25.
- Bunout D, Hirsch S, Pía de la Maza M, Muñoz C, Haschke F, Steenhout P, et al. Effects of prebiotics on the immune response to vaccination in the elderly. J. Parenter. Enteral. Nutr. 2002; 26(6):372-6.
- Duggan C, Penny ME, Hibberd P, Gil A, Huapaya A, Cooper A, et al. Oligofructose-supplemented infant cereal: 2 randomized, blinded, community-based trials in peruvian infants. Am. J. Clin. Nutr. 2003; 77(4):937-42.
- McLoughlin R, Berthon BS, Rogers GB, Baines KJ, Leong LEX, Gibson PG, et al. Soluble fibre supplementation with and without a probiotic in adults with asthma: A 7-day randomised, double blind, three way cross-over trial. EBioMedicine. 2019; 46:473-85.
- Bunout D, Barrera G, Hirsch S, Gattas V, de la Maza MP, Haschke F, et al. Effects of a nutritional supplement on the immune response and cytokine production in free-living chilean elderly. J. Parenter. Enteral. Nutr. 2004; 28(5):348-54.
- Langkamp-Henken B, Bender BS, Gardner EM, Herrlinger-garcia KA, Kelley MJ, Murasko DM, et al. Nutritional formula enhanced immune function and reduced days of symptoms of upper respiratory tract infection in seniors. J. Am. Geriatr. Soc. 2004, 52(1):3-12.
- Langkamp-Henken B, Wood SM, Herlinger-Garcia KA, Thomas DJ, Stechmiller JK, Bender BS, et al. Nutritional formula improved immune profiles of seniors living in nursing homes. J. Am. Geriatr. Soc. 2006; 54(12):1861-70.
- Lecerf JM, Dépeint F, Clerc E, Dugenet Y, Niamba CN, Rhazi L, et al. Xylo-oligosaccharide (XOS) in combination with inulin modulates both the intestinal environment and immune status in healthy subjects, while XOS alone only shows prebiotic properties. Br. J. Nutr. 2012; 108(10):1847-58.
- Moro G, Arslanoglu S, Stahl B, Jelinek J, Wahn U, Boehm G. A mixture of prebiotic oligosaccharides reduces the incidence of atopic dermatitis during the first six months of age. Arch. Dis. Child. 2006; 91(10):814-9.
- Arslanoglu S, Moro GE, Schmitt J, Tandoi L, Rizzardi S, Boehm G. Early dietary intervention with a mixture of prebiotic oligosaccharides reduces the incidence of allergic manifestations and infections during the first two years of life. J. Nutr. 2008; 138(6):1091-5.
- Arslanoglu S, Moro GE, Boehm G, Wienz F, Stahl B, Bertino E, et al. Early neutral prebiotic oligosaccharide supplementation reduces the incidence of some allergic manifestations in the first 5 years of life. J. Biol. Regul. Homeost. Agents. 2012; 26(S3):S49-S59.
- Perović J, Tumbas Šaponjac V, Kojić J, Krulj J, Moreno DA, García-Viguera C, et al. Chicory (Cichorium intybus L.) as a food ingredient - Nutritional composition, bioactivity, safety, and health claims: A review. Food Chem. 2021; 336:127676.
- EFSA. European Food Safety Authority (EFSA Panel on Dietetic Products, Nutrition and Allergies). Scientific opinion on the substantiation of a health claim related to “native chicory inulin” and maintenance of normal defecation by increasing stool frequency pursuant to Article of Regulation (EC) No 1924/2006. EFSA J. 2015; 13(1):3951.
- FDA. United States Food and Drug Administration. The declaration of certain isolated or synthetic non-digestible carbohydrates as dietary fiber on nutrition and supplement facts labels; guidance for industry; availability. Washington (DC): U.S. Food and Drug Administration, Health and Human Services. 2018:1-8.
- ANVISA. Agência Nacional de Vigilânica Sanitária. Alimentos com alegações de propriedades funcionais e ou de saúde. Brasília: ANVISA. 2016. Disponível em: http://www.agricultura.gov.br/assuntos/inspecao/produtosvegetal/legislacao-1/biblioteca-de-normas-vinhos-e-bebidas/alegacoes-de-propriedade-funcional-aprovadas_anvisa.pdf
- Briet F, Achour L, Flourié B, Beaugerie L, Pellier P, Franchisseur C, Bornet F, Rambaud JC. Symptomatic response to varying levels of fructo-oligosaccharides consumed occasionally or regularly. Eur J Clin Nutr. 1995; 49(7):501-7.
- Bonnema AL, Kolberg LW, Thomas W, Slavin JL. Gastrointestinal tolerance of chicory inulin products. J. Am. Diet. Assoc. 2010; 110(6):865-8.
- Bouhnik Y, Vahedi K, Achour L, Attar A, Salfati J, Pochart P, et al. Short-chain fructo-oligosaccharide administration dose-dependently increases fecal bifidobacteria in healthy humans. J. Nutr. 1999; 129(1):113-6.
- Azpiroz F, Molne L, Mendez S, Nieto A, Manichanh C, Mego M, et al. Effect of chicory-derived inulin on abdominal sensations and bowel motor function. J. Clin. Gastroenterol. 2017; 51(7):619-25.
- Micka A, Siepelmeyer A, Holz A, Theis S, Schön C. Effect of consumption of chicory inulin on bowel function in healthy subjects with constipation: a randomized, double-blind, placebo-controlled trial. Int. J. Food Sci. Nutr. 2017; 68(1):82-9.
- Chambers ES, Byrne CS, Rugyendo A, Morrison DJ, Preston T, Tedford C, et al. The effects of dietary supplementation with inulin and inulin-propionate ester on hepatic steatosis in adults with non-alcoholic fatty liver disease. Diabetes Obes. Metab. 2019; 21(2):372-6.
- Miles JP, Zou J, Kumar MV, Pellizzon M, Ulman E, Ricci M, et al. Supplementation of low- and high-fat diets with fermentable fiber exacerbates severity of DSS-induced acute colitis. Inflamm. Bowel Dis. 2017; 23(7):1133-43.
- Singh V, Yeoh BS, Walker RE, Xiao X, Saha P, Golonka RM, et al. Microbiota fermentation-NLRP3 axis shapes the impact of dietary fibres on intestinal inflammation. Gut. 2019; 68(10):1801-12.
* Doutora e Mestre em Ciências Biológicas (Botânica) pela Universidade de São Paulo; Pesquisadora aposentada do Núcleo de Pesquisa em Fisiologia e Bioquímica, Instituto de Botânica, São Paulo.
† Doutora e Mestre em Ciências Biológicas (Botânica) pela Universidade de São Paulo; Professora da Faculdade da Saúde, Universidade Metodista de São Paulo.
‡ Doutora e Mestre em Ciências Biológicas (Botânica) pela Universidade de São Paulo; Professora do Centro Universitário das Faculdades Metropolitanas Unidas.
§ Doutor e Mestre em Agronomia (Microbiologia Agrícola) pela Universidade de São Paulo; Servidor da Universidade Federal do ABC.